
| A. | 向AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 将Al投入到烧碱溶液中:2Al+2OH-═AlO2-+2H2O | |
| C. | 将Al(OH)3投入到烧碱溶液中:Al(OH)3+OH-═AlO2-+2H2O | |
| D. | 向NaHCO3溶液中加入适量KOH溶液:HCO3-+OH-═CO2↑+H2O |
分析 A.不符合反应客观事实;
B.原子个数不守恒;
C.二者反应生成偏铝酸钠和水;
D.反应实质是碳酸氢根离子与氢氧根离子生成碳酸根离子和水;
解答 解:A.氢氧化铝不溶于氨水,二者反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故A错误;
B.NaOH溶液和铝片的反应与氢氧化钠量的多少没有关系,往过量和少量NaOH溶液中投入铝片均发生反应:2Al+2OH-+2H2O═2AlO2-+3H2↑,故B错误;
C.将Al(OH)3投入到烧碱溶液中,离子方程式:Al(OH)3+OH-═AlO2-+2H2O,故C正确;
D.向NaHCO3溶液中加入适量KOH溶液,离子方程式:HCO3-+OH-═CO32-+H2O,故D错误;
故选:C.
点评 本题目考查学生离子方程式的书写和正误的判断方法,明确离子方程式书写方法是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
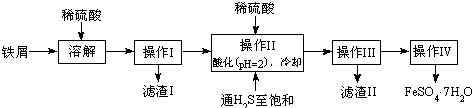
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
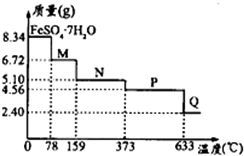
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
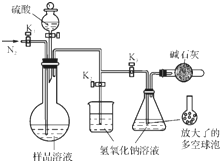 碳酸钠-过氧化氢加合物(aNa2CO3•bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:
碳酸钠-过氧化氢加合物(aNa2CO3•bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
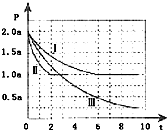 清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.
清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时每转移3mol电子,正极有1molK2FeO4被氧化 | |
| B. | 放电时负极反应为Zn+2e-+2OH-═Zn(OH)2 | |
| C. | 充电时阳极反应为Fe(OH)3-3e-+5OH-═FeO42-+4H2O | |
| D. | 放电时正极附近溶液的碱性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可加入烧碱溶液以提高电池的性能,碱性电池的能量和可储存时间均较高 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 充电过程中,电池正极材料的质量减少 | |
| D. | 放电时电池正极反应为:FePO4+Li+-e-═LiFePO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100℃下水的电离程度较大 | B. | 前者的C(H+)较后者小 | ||
| C. | 水的电离过程是一个放热过程 | D. | 温度越高,Kw越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol•L-1 | B. | 3.36 mol•L-1 | ||
| C. | 1.5 mol•L-1 | D. | 缺少数据,无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com