
| A、标准状况下,电解CuCl2溶液生成22.4L Cl2时,理论上转移NA个电子 |
| B、常温常压下,电解水生成32g O2时,转移电子总数为2NA |
| C、标准状况下,11.2L CH3CH2OH 中含有的分子数目为0.5NA |
| D、常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |


科目:高中化学 来源: 题型:
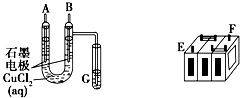 (Ⅰ)某铅蓄电池的正、负极标记被磨损.试用如图装置设计实验,识别出此铅蓄电池的正负极.
(Ⅰ)某铅蓄电池的正、负极标记被磨损.试用如图装置设计实验,识别出此铅蓄电池的正负极.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、推广使用无磷洗衣粉 |
| B、使用清洁燃料的公交车 |
| C、减少含硫化石燃料的大量燃烧 |
| D、使用不易降解的一次性塑料餐具 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的pH值变小 |
| B、醋酸的电离度增大 |
| C、溶液的导电能力增强 |
| D、中和此溶液所需的0.1mol?L-1 NaOH溶液的体积增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )| A、R和Z形成的化合物属于共价化合物 |
| B、Y单质能在X的单质中燃烧,生成淡黄色物质Y2X2 |
| C、X、Z形成的化合物化学式为Z2X3,它属碱性氧化物 |
| D、在常温下,Z单质能溶于W的最高价氧化物对应水化物浓溶液中,生成氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、由X、Y、Z、M四种元素形成的化合物一定有共价键 |
| B、原子半径:W>Z>Y>X>M |
| C、由X元素形成的单质一定是原子晶体 |
| D、XZ2、X2M2、W2Z2均为直线型的共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素X与氢形成原子个数比为1:1的化合物有多种 |
| B、元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
| C、Z的原子半径比Y的原子半径大 |
| D、元素Z可与元素X形成共价化合物XZ2,且各微粒均满足8电子的稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com