
【题目】2.8gFe全部溶于一定浓度200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列说法正确的是( )
A.反应后溶液中存在Fe3+和Fe2+B.反应后的溶液最多还能溶解1.82g Fe
C.反应后溶液中c(NO3-)=0.75mol/LD.1.12L气体是NO、NO2的混合气体
【答案】B
【解析】
A、测得反应后溶液的pH为1,则HNO3过量,故Fe只可能转化为Fe3+;
B、计算原硝酸溶液中硝酸的物质的量,根据氮元素守恒可知n原来(HNO3)=3n[Fe(NO3)3]+n剩余(HNO3)+n(NO),当生成Fe(NO3)2 时原硝酸溶解的铁最多,据此计算原硝酸溶解的铁的最大重量,减去已经溶解的2.8g,即为反应后的溶液最多还能溶解的Fe的质量;C、由题目信息可知,反应后溶液为硝酸铁、硝酸的混合溶液,根据电荷守恒溶液中有3c(Fe3+)+c(H+)=c(NO3-),根据铁元素守恒由n(Fe)=n(Fe3+),据此计算;
D、2.8gFe的物质的量为0.05mol,根据电子转移守恒,利用极限假设法解答,若只生成NO,计算生成NO的体积;若只生成NO2,计算生成的NO2体积,根据体积判断。
A、反应后溶液pH为1,故HNO3过量,Fe只可能转化为Fe3+,故A错误;
B、由B中分析可知,原硝酸是稀硝酸,反应生成NO,由氮元素守恒可知n原来(HNO3)=3n[Fe(NO3)3]+n剩余(HNO3)+n(NO)=0.05mol×3+0.1mol/L×0.2+0.05mol=0.22mol,生成Fe(NO3)2、NO时原硝酸溶解的铁最多,由3 Fe+8HNO3=3Fe(NO3)2+2 NO↑+4H2O 可知,0.22molHNO3最多溶解铁![]() ×0.22mol,质量为
×0.22mol,质量为![]() ×0.22mol×56g/mol=4.62g,故还能溶解铁4.64g-2.8g=1.82g,故B正确;
×0.22mol×56g/mol=4.62g,故还能溶解铁4.64g-2.8g=1.82g,故B正确;
C、反应后溶液为硝酸铁、硝酸的混合溶液,故溶液中有3c(Fe3+)+c(H+)=c(NO3-),根据铁元素守恒由n(Fe)=n(Fe3+)=0.05mol,所以c(Fe3+)=![]() =0.25mol/L,反应后溶液pH为1,所以c(H+)=0.1mol/L,所以c(NO3-)=0.25mol/L×3+0.1mol/L=0.85mol/L,故C错误;
=0.25mol/L,反应后溶液pH为1,所以c(H+)=0.1mol/L,所以c(NO3-)=0.25mol/L×3+0.1mol/L=0.85mol/L,故C错误;
D、2.8gFe的物质的量为![]() =0.05mol,若只生成NO,根据电子转移守恒可知,n(NO)=
=0.05mol,若只生成NO,根据电子转移守恒可知,n(NO)=![]() =0.05mol,则V(NO)=0.05mol×22.4L/mol=1.12L;若只生成NO2,根据电子转移守恒可知,n(NO2)=
=0.05mol,则V(NO)=0.05mol×22.4L/mol=1.12L;若只生成NO2,根据电子转移守恒可知,n(NO2)=![]() =0.15mol,V(NO2)=0.15mol×22.4L/mol=3.36L,由于实际生成气体1.12L,故只生成NO,故D错误。
=0.15mol,V(NO2)=0.15mol×22.4L/mol=3.36L,由于实际生成气体1.12L,故只生成NO,故D错误。
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应mA(g)+nB(s)![]() 3C(g)达到平衡时,测得c(A)为0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)为0.3 mol/L,则下列判断不正确的是
3C(g)达到平衡时,测得c(A)为0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)为0.3 mol/L,则下列判断不正确的是
A.混合气体密度一定减小B.平衡一定向逆反应方向移动
C.化学计量数:m+n>3D.物质C的体积分数增加了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学好化学知识的重要基础,下列有关化学用语表示正确的有( )
①用电子式表示HCl的形成过程:![]()
②MgCl2的电子式:![]() ③质量数为133、中子数为78的铯原子:
③质量数为133、中子数为78的铯原子:![]() Cs
Cs
④乙烯、乙醇结构简式依次为:CH2=CH2、C2H6O ⑤S2﹣的结构示意图:![]()
⑥次氯酸分子的结构式:H-O-Cl ⑦CO2的分子模型示意图:![]()
A. 3个 B. 4个 C. 5个 D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一容积可变的容器中,反应2A(g)+B(g)![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向正反应方向移动的是( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向正反应方向移动的是( )
A.均减半B.均加倍C.均增加1molD.均减少1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是( )
A.NaOH溶液与![]() 反应,当
反应,当![]() :
:![]() :3时:
:3时:![]()
B.酸性条件下![]() 溶液与KI溶液发生反应生成
溶液与KI溶液发生反应生成![]() :
:![]()
C.![]() 溶液中加入过量的氨水:
溶液中加入过量的氨水:![]()
D.1![]() 的
的![]() 溶液和
溶液和![]()
![]() 的HCl等体积互相均匀混合:
的HCl等体积互相均匀混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲胺![]() 为一元弱碱,在水中的电离方式与氨相似。已知:
为一元弱碱,在水中的电离方式与氨相似。已知:![]() 时,
时,![]() 的电离常数
的电离常数![]() 。
。![]() 时,用
时,用![]() 的稀硫酸滴定
的稀硫酸滴定![]() 的二甲胺溶液,溶液中
的二甲胺溶液,溶液中![]() 的物质的量浓度的负对数
的物质的量浓度的负对数![]() 与所加稀硫酸的体积
与所加稀硫酸的体积![]() 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
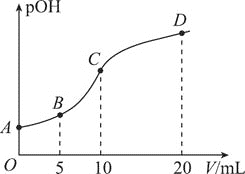
A.已知![]() ,则A点溶液的pH约为
,则A点溶液的pH约为![]()
B.C点溶液中存在![]()
C.B点溶液中存在![]()
D.A、B、C、D四点溶液中,水电离出来的![]() :
:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.![]() 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃,分别向10ml浓度均为1mol/L的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH)与溶液浓度的对数(1gc)的关系如图所示。下列叙述正确的是
己知:(1)HA的电离平衡常数Ka=[c(H+)·c(A-)]/[c(HA)-c(A-)]≈c2(H+)/c(HA);(2)pKa=-lgKa

A. 弱酸的Ka随溶液浓度的降低而增大
B. a点对应的溶液中c(HA)=0.1mol/L,pH=4
C. 酸性:HA<HB
D. 弱酸HB的pKa=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型漂白剂(如下图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是

A.工业上通过电解熔融的WX来制得W
B.W、X对应的简单离子半径顺序为:W>X
C.Y的最高价氧化物对应水化物为弱酸
D.该漂白剂中各元素均满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com