


科目:高中化学 来源: 题型:
 短周期元素X、Y、Z的位置如图所示,已知Y、Z两元素原子序数之和是X原子序数的4倍.X、Y、Z三元素的元素符号是( )
短周期元素X、Y、Z的位置如图所示,已知Y、Z两元素原子序数之和是X原子序数的4倍.X、Y、Z三元素的元素符号是( )| A、N、Si、S |
| B、O、P、C1 |
| C、F、S、Ar |
| D、C、A1、P |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
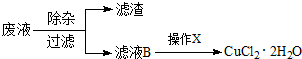
查看答案和解析>>
科目:高中化学 来源: 题型:
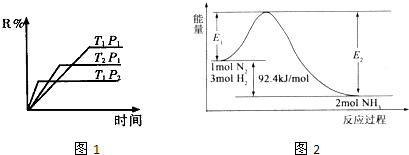
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 起始状态(mol) | 平衡时HBr 物质的量(mol) | ||
| H2 | Br2 | HBr | ||
| 已知 | 1 | 2 | 0 | a |
| ① | 2 | 4 | 0 | |
| ② | 1 | 0.5a | ||
| ③ | m | n(n≥2m) | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
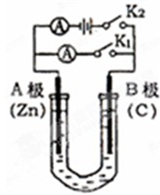 如图所示,U形管内盛有100mL的溶液,请按要求回答下列回答.
如图所示,U形管内盛有100mL的溶液,请按要求回答下列回答.查看答案和解析>>
科目:高中化学 来源: 题型:
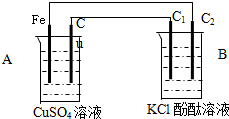 按如图装置进行实验,并回答下列问题:
按如图装置进行实验,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用甲醛溶液浸泡水产品以延长保质期 |
| B、在饲料中添加“瘦肉精”以增加猪肉的瘦肉含量 |
| C、高层住房着火.立即打开所有门窗 |
| D、燃着的酒精灯不慎碰到,立即用湿布盖灭 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com