
| 编号 | 起始状态(mol) | 平衡时HBr 物质的量(mol) | ||
| H2 | Br2 | HBr | ||
| 已知 | 1 | 2 | 0 | a |
| ① | 2 | 4 | 0 | |
| ② | 1 | 0.5a | ||
| ③ | m | n(n≥2m) | ||
| x |
| 2 |
| x |
| 2 |
| x |
| 2 |
| 1 |
| n-m |
| a |
| n(HBr) |


科目:高中化学 来源: 题型:
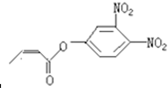 ,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )| A、遇FeCl3溶液均显紫色 |
| B、均能发生银镜反应 |
| C、均能与溴水发生反应 |
| D、均能与NaOH溶液发生反应下列 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 物质 | 0℃ | 50℃ | 80℃ |
| Ca(0H)2 | 0.173 | 0.130 | 0.004 |
| Ba(OH)2 | 1.64 | 13.1 | 101.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
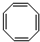 )分子中碳碳键的键长有两种,分别为1.33×10-10m(4个)和1.46×10-10m(4个).
)分子中碳碳键的键长有两种,分别为1.33×10-10m(4个)和1.46×10-10m(4个).
查看答案和解析>>
科目:高中化学 来源: 题型:
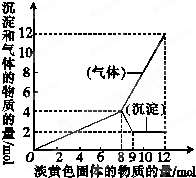 (1)将一个用金属铝做的易拉罐充满CO2,然后往罐内注入足量的NaOH的溶液.用胶布封罐口,经过一段时间后,罐壁内凹而瘪,再过一段时间后,罐壁又重新鼓起.
(1)将一个用金属铝做的易拉罐充满CO2,然后往罐内注入足量的NaOH的溶液.用胶布封罐口,经过一段时间后,罐壁内凹而瘪,再过一段时间后,罐壁又重新鼓起.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2molA+1molB |
| B、6molC+2molD |
| C、3molC+1molD |
| D、4molA+2molB+3molC |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com