
【题目】一定温度下,向一个容积为3L的真空密闭容器中通入1molN2和3molH2,2min后,测得容器内的压强是开始时的0.8倍,则这段时间内V(H2)为( )
A.0.2mol/(L·min)B.0.6mol/(L·min)
C.0.1mol/(L·min)D.0.3mol/(L·min)
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH﹣ , CO32﹣ , AlO2﹣ , SiO32﹣ , SO42﹣ , K + , Na + , Fe3 + , Mg2 + , Al3 + 等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是

A.原溶液中一定含有Na2SO4
B.反应后形成的溶液溶质为NaCl
C.原溶液中含有CO32﹣与AlO2﹣的物质的量比为3:4
D.原溶液中一定含有的离子是OH﹣,CO32﹣,SiO32﹣,AlO2﹣,K +
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】升高温度能使反应速率加快,下列叙述正确的是( )
A. 降低反应所需的活化能
B. 对于吸热反应、放热反应,反应速率同等程度加大
C. 体系中活化分子总数不变
D. 使反应体系的活化分子百分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科研人员设想用如图所示装置生产硫酸。
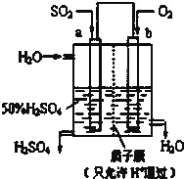
①上述生产硫酸的总反应方程式为_____,b是_____极,a电极反应式为_____,生产过程中H+向_____(填a或b)电极区域运动。
②该小组同学反思原电池的原理,其中观点正确的是_____(填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原申池装置需要2个活泼性不同的金属电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成原电池装置,则负极材料为_____,溶液C为_____。
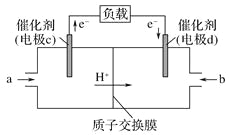
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜(只允许H+通过)燃料电池的结构示意图如:电池总反应为2CH3OH+3O2=2CO2+4H2O,c电极为_____(填“正极”或“负极”),c电极反应方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中A与B反应生成C,其反应速率分别用V(A)、V(B)、V(C)表示。已知V(A)、V(B)、V(C)之间有以下关系2V(B)=3V(A),3V(C)=2V(B),则此反应可表示为( )
A.A+B=CB.A+3B=2CC.3A+B=2CD.2A+3B=2C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
A | B | C | D |
|
|
|
|
平衡后升温,NO2含量降低 | 0~2 s内,v(O3)=0.2 mol·L-1·s-1 | v正:b点>a点 b点:v逆>v正 | 恒温,t1时再充入O3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)
将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。

(1)各装置的连接顺序为___→___→___→________→____。___________
(2)装置B中多孔球泡和搅拌棒的作用是_;装置C的作用是__。
(3)制备Cl2O的化学方程式为___。
(4)反应过程中,装置B需放在冷水中,其目的是___。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是____。
(测定浓度)
(6)已知次氯酸可被FeSO4等物质还原。用下列实验方案测定装置E所得溶液中次氯酸的物质的量浓度:量取10 mL上述次氯酸溶液,并稀释至100 mL,再从其中取出10.00 mL于锥形瓶中,并加入10.00 mL 0.80 mol·L-1的FeSO4溶液,充分反应后,用0.050 00 mol·L-1的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液24.00 mL,则原次氯酸溶液的浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是
①C(s)+O2(g)=CO2(g) ΔH1 C(s)+![]() O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
②S(s)+O2(g)=SO2(g) ΔH3 S(g)+O2(g)=SO2(g) ΔH4
③H2(g)+![]() O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)=2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)=2H2O(l) ΔH6
④CaCO3(s)=CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
A. ① B. ④ C. ①②③ D. ②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com