
 实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:
实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
分析 (1)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器来解答;
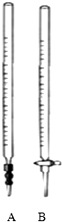
(2)准确量取10.00mL的烧碱溶液,应选用碱式滴定管;
(3)根据滴定时,两眼注视锥形瓶中溶液颜色的变化;根据滴定前溶液为红色,滴定终点时溶液为无色判断滴定终点;
(4)先分析所耗盐酸标准液的体积的有效性,然后求出所耗盐酸标准液的体积平均值,然后根据关系式HCl~NaOH来解答.
(5)根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
解答 解:(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,
故答案为:250ml容量瓶;胶头滴管、药匙;
(2)氢氧化钠溶液是碱溶液,需要用碱式滴定管A准确量取10.00ml,
故答案为:A;
(3)滴定时,两眼注视锥形瓶中溶液颜色的变化,以便准确判断终点的到达;滴定前溶液为红色,滴定终点时溶液为无色,所以滴定终点现象为滴最后一滴溶液由红色变为无色,半分钟不褪色,
故答案为:锥形瓶中溶液颜色的变化;溶液由红色变为无色且半分钟不恢复原色;
(4)所耗盐酸标准液的体积分别为:19.90mL,20.10mL,两组数据均有效,盐酸标准液的平均体积为20.00mL;
HCl~NaOH
0.2000mol/L×20.00mL C(NaOH)×10mL
C(NaOH)=0.4mol/L,则250mL的溶液中含有NaOH的质量为:0.4mol/L×0.25L×40g/mol=4.0g,烧碱样品的纯度为$\frac{4.0g}{4.3g}$×100%=93.0%;
故答案为:93.0%;
(5)①滴定前读数正确,滴定终点读数时仰视,造成V(标准)偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,c(待测)偏大;
②未用标准液润洗滴定管,标准液被稀释,造成V(标准)偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,c(待测)偏大;
③滴定终点时发现滴定管尖嘴处悬挂着一滴溶液,造成V(标准)偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,c(待测)偏大;
故答案为:偏大;偏大;偏大;
点评 本题考查了中和滴定操作及误差分析,操作时要规范,分析误差时要看是否影响标准体积的用量即可,本题难度中等.


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH | B. | 醋酸的电离常数 | ||
| C. | 中和时所需NaOH的量 | D. | 溶液中的c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 都是强酸 | B. | 都是弱酸 | ||
| C. | a1 是强酸,a2 是弱酸 | D. | a1 是弱酸,a2 是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加过程中,当溶液中c(Cu 2+)=2.2×10-2mol/L时,溶液的pH=9 | |
| B. | 滴加过程中,当溶液的pH=7时,溶液中2c(NH4+)=c(SO4 2-) | |
| C. | 若滴加pH=11的Na0H溶液,Cu2+完全沉淀时消耗溶液的体积小于V | |
| D. | 若将氨水加水稀释,则稀释过程中,c(NH4+)/c(NH3•H2O)始终保持增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com