
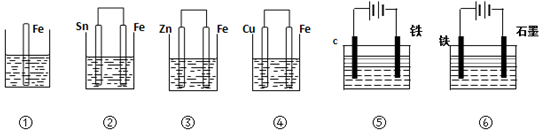
| A. | ④>②>①>③>⑤>⑥ | B. | ⑥>④>②>①>③>⑤ | C. | ④>②>⑤>③>⑥>① | D. | ⑥>③>②>④>①>⑤ |
分析 金属Fe发生腐蚀快慢顺序为:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极,据此分析解答.
解答 解:金属Fe发生腐蚀快慢顺序为:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极,
①中Fe发生化学腐蚀;
②中Fe作负极,加速被腐蚀;
③中Fe作正极,被保护;
④Fe作负极而加速被腐蚀,但其被腐蚀速率大于②;
⑤作电解池阴极,被保护;
⑥作电解池阳极而加速被腐蚀;
所以Fe被腐蚀快慢顺序是⑥>④>②>①>③>⑤,故选B.
点评 本题以金属腐蚀与防护为载体考查原电池和电解池原理,为高频考点,明确哪种电极被腐蚀、哪种电极被保护是解本题关键,注意:电化学腐蚀速率大于化学腐蚀速率.


 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入BaCl2溶液,产生了白色沉淀.则溶液中一定含有SO42- | |
| B. | 加入BaCl2溶液产生了白色沉淀,再加盐酸,沉淀不消失,则溶液中一定含有SO42- | |
| C. | 加入盐酸酸化的氯化钡溶液,产生白色沉淀,则溶液中一定有SO42- | |
| D. | 加入盐酸,溶液无明显现象,再加BaCl2溶液,产生了白色沉淀.则溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤ | B. | ②④ | C. | ①② | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com