
| A. |  实验室制NH3 | B. | 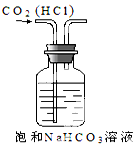 除去CO2中的HCl | C. |  检验K2CO3中的K+ | D. | 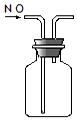 收集NO气体 |
分析 A.氯化铵与氢氧化钙加热生成氨气,氨气的密度比空气的密度小;
B.HCl与碳酸氢钠反应生成二氧化碳;
C.观察K的焰色反应透过蓝色的钴玻璃;
D.NO不能利用排空气法收集,易被氧化.
解答 解:A.氯化铵与氢氧化钙加热生成氨气,氨气的密度比空气的密度小,向下排空气法收集,试管口塞一团棉花防止与空气对流,故A正确;
B.HCl与碳酸氢钠反应生成二氧化碳,图中导管长进短出可除杂,故B正确;
C.观察K的焰色反应透过蓝色的钴玻璃,图中操作合理,故C正确;
D.NO不能利用排空气法收集,易被氧化,应选排水法收集,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的制备、混合物分离提纯、焰色反应为解答的关键,侧重分析与实验能力的考查,注意元素化合物与实验的结合,题目难度不大.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | K1=K2 | B. | K1<K2 | C. | K1>K2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{17}O$原子核内含有8个中子 | B. | ${\;}_{8}^{17}O$原子核内含有8个质子 | ||
| C. | ${\;}_{8}^{17}O$原子核外有17个电子 | D. | ${\;}_{8}^{17}O$原子核内含有17个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
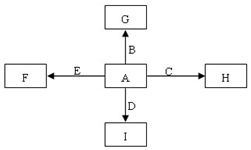 图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G$\stackrel{高温}{→}$B+H能放出大量的热,该反应曾应用于铁轨的焊接;
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G$\stackrel{高温}{→}$B+H能放出大量的热,该反应曾应用于铁轨的焊接; ,它的空间构型是直线型;
,它的空间构型是直线型;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| N2H4 | N2O4 | |
| 密度/g/cm3 | 1.004 | 1.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
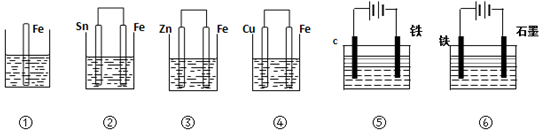
| A. | ④>②>①>③>⑤>⑥ | B. | ⑥>④>②>①>③>⑤ | C. | ④>②>⑤>③>⑥>① | D. | ⑥>③>②>④>①>⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com