
分析 A加入C中有气体产生,则A、C为H2SO4、Na2CO3中的一种,BaCl2与H2SO4、Na2SO4、Na2CO3反应均生成白色沉淀,结合D加入A中有沉淀产生,可知D为BaCl2,A加入B中无反应,则A为H2SO4,B为Na2SO4,以此来解答.
解答 解:A加入C中有气体产生,则A、C为H2SO4、Na2CO3中的一种,BaCl2与H2SO4、Na2SO4、Na2CO3反应均生成白色沉淀,结合D加入A中有沉淀产生,可知D为BaCl2,A加入B中无反应,则A为H2SO4,B为Na2SO4,C为Na2CO3,
(1)由上述分析可知,A为H2SO4,B为Na2SO4,故答案为:H2SO4;Na2SO4;
(2)A与C反应的离子方程式为2H++CO32-=CO2↑+H2O,A与D反应的离子方程式为Ba2++SO42-=BaSO4↓,
故答案为:2H++CO32-=CO2↑+H2O;Ba2++SO42-=BaSO4↓.
点评 本题考查无机物的推断,为高频考点,把握A与C生成气体、A与D生成沉淀为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的综合应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
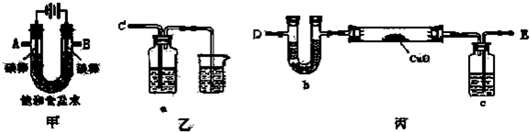
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,8gO2含有4NA个电子 | |
| B. | 任意条件下,16g O3所含的原子数为NA | |
| C. | 由CH4和C2H6组成的混合物中共有NA个分子,其中的氢原子数为5NA | |
| D. | 46 g二氧化氮和46 g四氧化二氮含有的原子数均是6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤ | B. | ②④ | C. | ①② | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和甲烷都能发生加成反应 | |
| B. | 煤焦油、石油、花生油都属于烃 | |
| C. | 甲烷、乙烯、苯都可通过石油分馏得到 | |
| D. |  + +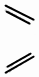 $\stackrel{△}{→}$ $\stackrel{△}{→}$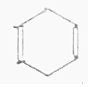 反应属于加成反应 反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
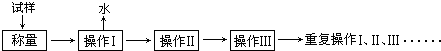
 电子天平 b.
电子天平 b. 坩埚 c.
坩埚 c. 干燥器 d.
干燥器 d. 酒精喷灯
酒精喷灯| 加热前质量 | 加热后质量 | |
| m1(容器) | m2(容器+晶体) | m3(容器+无水硫酸铜) |
| 5.200g | 7.900g | 6.900g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com