
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2++2K++Mg2++4SO42—+2H2O
2Ca2++2K++Mg2++4SO42—+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:

(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:
_____________________________________________________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入________溶液调滤液pH至中性。

(4)不同温度下,K+的浸出浓度与溶浸时间的关系如图。由图可得,随着温度升高,
①_______________________________________________________,
②_______________________________________________________。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32— CaCO3(s)+SO
CaCO3(s)+SO
已知298 K时,Ksp(CaCO3)=2.80×10-9,
Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。
(1)Mg(OH)2 CaSO4
(2)加入Ca(OH)2溶液,Mg2+与OH-结合生成Mg(OH)2沉淀,Mg2+浓度减小,平衡正向移动,K+增多
(3)K2CO3 H2SO4
(4)①溶浸平衡向右移动 ②K+的溶浸速率增大
(5)CaSO4(s)+CO32— CaCO3(s)+SO42—的平衡常数K=
CaCO3(s)+SO42—的平衡常数K=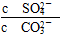 ,据Ksp(CaSO4)、Ksp(CaCO3)可知:
,据Ksp(CaSO4)、Ksp(CaCO3)可知:  ,
, 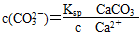 ,则有K=
,则有K=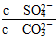 =
=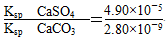 =1.75×104。
=1.75×104。
【解析】解题时,要依据制备K2SO4的工艺流程,结合物质的分离与提纯的原则进行分析。
(1)杂卤石中加入Ca(OH)2溶液,Mg2+与OH-结合生成Mg(OH)2沉淀,CaSO4微溶于水,过滤后,滤渣中含有Mg(OH)2、CaSO4及未溶解的杂卤石。
(2)加入Ca(OH)2溶液,Mg2+与OH-结合生成Mg(OH)2沉淀,使c(Mg2+)减小,杂卤石的溶解平衡正向移动,同时c(Ca2+)与c(SO42—)均增大,从而析出CaSO4沉淀,K+留在滤液中。
(3)滤液中含有Ca2+、OH-,可先加入过量K2CO3溶液,除去Ca2+,过滤后,再加入稀H2SO4调节溶液的pH至中性。
(4)①溶浸平衡向右移动;②K+的溶浸速率增大。


科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学反应速率与化学平衡练习卷(解析版) 题型:填空题
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g)ΔH1
②IO-(aq)+H+(g)=HOI(aq)ΔH2
③HOI(aq)+I-(aq)+H+(aq)=I2(aq)+H2O(l)ΔH3
总反应的化学方程式为_________________________________,
其反应热ΔH=______________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)  I3-(aq),其平衡常数表达式为________。
I3-(aq),其平衡常数表达式为________。
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图1),某研究小组测定两组实验中I3-浓度和体系pH,结果见图2和下表。

编号 | 反应物 | 反应前pH | 反应前pH |
第1组 | O3+I- | 5.2 | 11.0 |
第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
①第1组实验中,导致反应后pH升高的原因是______________。
②图1中的A为________。由Fe3+生成A的过程能显著提高I-的转化率,原因是____________________。
③第2组实验进行18 s后,I3-浓度下降。导致下降的直接原因有(双选)________。
A.c(H+)减小
B.c(I-)减小
C.I2 (g)不断生成
D.c(Fe3+)增加
(4)据图2,计算3~18 s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 元素及其化合物练习卷(解析版) 题型:选择题
下列关于有机物的说法中,正确的一组是( )
①淀粉、油脂、蛋白质在一定条件下都能发生水解反应
②“乙醇汽油”是在汽油中加入适量乙醇而成的一种燃料,它是一种新型化合物
③除去乙酸乙酯中残留的乙酸,加过量饱和碳酸钠溶液振荡后,静置分液
④石油的分馏和煤的气化都是发生了化学变化
⑤淀粉遇碘酒变蓝色,在加热条件下葡萄糖能与新制Cu(OH)2悬浊液发生反应
⑥塑料、橡胶和纤维都是合成高分子材料
A.①③⑤ B.②④⑥ C.①②⑤ D.③④⑥
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第8讲电化学练习卷(解析版) 题型:填空题
太阳能电池可用做电解的电源(如图)。

(1)若c、d均为惰性电极,电解质溶液为硫酸铜溶液,电解过程中,c极先无气体产生,后又生成气体,则c极为________极,在电解过程中,溶液的pH________(填“增大”、“减小”或“不变”),停止电解后,为使溶液恢复至原溶液应加入适量的________。
(2)若c、d均为铜电极,电解质溶液为氯化钠溶液,则电解时,溶液中氯离子的物质的量将________(填“增大”、“减小”或“不变”)。
(3)若用石墨、铁作电极材料,可组装成一个简易污水处理装置。其原理是:加入试剂调节污水的pH在5.0~6.0之间。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的有色沉淀具有吸附性,吸附污物而沉积,起到凝聚净化作用。该装置中,阴极的电极反应式为__________________________;阳极区生成的有色沉淀是________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第8讲电化学练习卷(解析版) 题型:选择题
如图所示,?为直流电源,?为浸透饱和氯化钠溶液和酚酞试液的滤纸,?为电镀槽。接通电路(未闭合K)后发现?上的c点显红色。为实现铁片上镀铜,接通K后,使c、d两点短路。下列叙述不正确的是( )。

A.b为直流电源的负极
B.f极为阴极,发生还原反应
C.e极材料为铁片,f极材料为铜片
D.可选用CuSO4溶液或CuCl2溶液作电镀液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第7讲水溶液中的离子平衡练习卷(解析版) 题型:选择题
下列关于各溶液的描述中正确的是( )。
A.pH相等的①NH4Cl,②(NH4)2SO4,③NH4HSO4的溶液中,c(NH4+)大小:①=②=③
B.常温下,在10 mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≤20 mL
C.向1.00 L 0.3 mol·L-1的NaOH溶液中缓慢通入CO2气体至溶液增重8.8 g,所得溶液中:3c(Na+)=2[c(HCO3—)+c(CO32—)+c(H2CO3)]
D.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)-c(CH3COOH)=c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第6讲反应速率和化学平衡练习卷(解析版) 题型:填空题
向一容积不变的密闭容器中充入一定量A和B,发生反应:xA(g)+2B(s) yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)用A的浓度变化表示该反应0~10 min内的平均反应速率v(A)=________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是________;第16 min引起曲线变化的反应条件可能是________。
①减压 ②增大A的浓度 ③增大C的量 ④升温
⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ的平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第5讲化学反应与能量练习卷(解析版) 题型:选择题
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是( )。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第1讲物质组成性质分类练习卷(解析版) 题型:选择题
下列说法正确的是( )。
A.蛋白质在氧气中完全燃烧转化为水和二氧化碳
B.淀粉和纤维素的分子式均可表示成(C6H10O5)n,它们互为同分异构体
C.与碱反应生成盐和水的氧化物均为酸性氧化物
D.离子化合物中可能含有共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com