
����Ŀ��������Ⱦ��(��S��ʾ) Ϳ������TiO2����(�ɵ���) �����Ƴ�����һ���缫������Ⱦ�Ͽ����չ��ܽ�����Ⱦ��S������������S* (���Թ�������)����������ط�Ӧ:TiO2/S![]() TiO2/S*(����̬)��TiO2/S*- e-��TiO2/S+ 2TiO2/S+ +3I-��2TiO2/S+I3-(ע: S��S*�������ʣ��ǹ���Ⱦ�ϵĴ���)
TiO2/S*(����̬)��TiO2/S*- e-��TiO2/S+ 2TiO2/S+ +3I-��2TiO2/S+I3-(ע: S��S*�������ʣ��ǹ���Ⱦ�ϵĴ���)
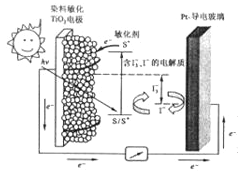
���й��ڸ�̫���ܵ�������������
A. ��ع���ʱ��Ⱦ��������TiO2 �缫Ϊ����
B. ��ع���ʱ�����������ķ�ӦΪI3-+2e-=3I-
C. ��ع��������У���������S��S*��Ҫ�����������ܷ�Ӧ�й�������S ������
D. �õ�ؽ�����ֱ��ת��Ϊ����
���𰸡�D
��������A��������Ⱦ������TiO2�缫ͨ�����·����Pt-���粣������ع���ʱ��Ⱦ��������TiO2�缫Ϊ������A����ȷ��B��Pt-���粣��Ϊ����������ͼʾ�����������ķ�ӦΪI3-+2e-=3I-��B����ȷ��C����ع��������й�������S��S*��Ҫ���չ���������Ⱦ�������缫�ϵ���ط�Ӧ��TiO2/S![]() TiO2/S*��TiO2/S*-e-��TiO2/S+��2TiO2/S++3I-��2TiO2/S+I3-�������ܷ�ӦʽΪ3I--2e-=I3-��������ӦʽΪI3-+2e-=3I-���ܷ�Ӧ�й�������S�����ģ�C����ȷ��D������Ⱦ�����չ��ܽ�����Ⱦ��S������������S*���˹��̽�����ת��Ϊ������S*�������������ĵ�ط�Ӧ�н���ѧ��ת��Ϊ���ܣ�����û��ֱ��ת��Ϊ���ܣ�D�����ѡD��
TiO2/S*��TiO2/S*-e-��TiO2/S+��2TiO2/S++3I-��2TiO2/S+I3-�������ܷ�ӦʽΪ3I--2e-=I3-��������ӦʽΪI3-+2e-=3I-���ܷ�Ӧ�й�������S�����ģ�C����ȷ��D������Ⱦ�����չ��ܽ�����Ⱦ��S������������S*���˹��̽�����ת��Ϊ������S*�������������ĵ�ط�Ӧ�н���ѧ��ת��Ϊ���ܣ�����û��ֱ��ת��Ϊ���ܣ�D�����ѡD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���˹��ϳ��л�������H��·�߿ɼ�ʾ��ͼ�� 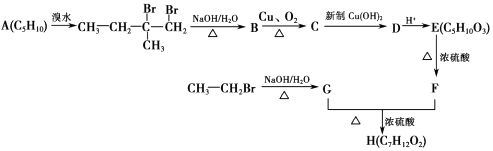 ��֪��F�ĺ˴Ź����������ĸ��壬��������Ϊ1��1��3��3��
��֪��F�ĺ˴Ź����������ĸ��壬��������Ϊ1��1��3��3��
��ش��������⣺
��1��A�����ƣ�ϵͳ������Ϊ��C�й����ŵĽṹ��ʽΪ ��
��2��G+F��H�ķ�Ӧ����Ϊ��H�Ľṹ��ʽΪ ��
��3��B��C�Ļ�ѧ����ʽΪ ��
��4��E��F�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����Ҫ���л���Ԫ�ᣬ�ܹ��������η�Ӧ��������Ӧ����������Ӧ�ȣ��������Ԫ�����Ԫ�����۳ɸ߷��Ӿۺ���ȣ��Ǻϳ�����-66��ԭ�ϣ���ҵ�ϻ����������������ɵõ������ᣬ�ǵ��͵�������ԭ��Ӧ��
 ��H<0
��H<0
�����������:
���� | ��Է������� | �ܶ�(20��) g/cm3 | �۵�(��) | �е�(��) | �ܽ��S(g100g�ܼ�) | ||
ˮ | �Ҵ� | ���� | |||||
������ | 100 | 0.96 | 25.2 | 161 | ���� | ���� | |
������ | 146 | 1.36 | 151 | 265 | ����(S���¶Ƚ��Ͷ���С) | ���� | �� |
I.������ֲ�Ʒ���Ʊ�
��������:װ��C�м���50mL�е�Ũ�ȵ�����(����)��Ͷ���ʯ������һ�� װװ��A��װ��B���¶ȼƣ��������裬����Һ��Ͼ��ȣ������ȵ�80������װ��A�μ�2�λ���������Ӧ������ʼ���¶��漴������85~90������װ��A��С�ĵ���μ��뻷���������������85-90���¼���2-3 ���ӣ�������1.000g��������
��ش���������:

��1����Ӧ��ά���¶���85~90������ò�ȡ______�������Է���ά���¶���85~90����ԭ��:__________��
��2�� װ���Ҳ��ձ��е�NaOH ��Һ��������:_______________��
II.������ֲ�Ʒ���ᴿ��Ӧ��
�������������ȵ���װ��C �еIJ�Ʒ������ˮ�н�����ȴ�������ľ����ڲ���©���Ͻ��г��ˣ�����������ؽᾧ���ٷֱ���3mL ��ˮ������ϴ�Ӽ����ᾧ�����������ˣ���������3mL��ˮϴ��һ�Σ��ٳ��ˡ�ȡ����Ʒ���������أ��ø���ļ�����0.860g��
��ش���������:
��3�� �������ͨ���ˣ����˵��ŵ�������_________
��4���ڳ��˹����У��ñ�ˮϴ�������ļ����ᾧ���ԭ����___________��
��5����ʵ��IJ���Ϊ: _______% (�������3 λ��Ч����)
��6����ҵ���ü��������Ҷ�����Ӧ�γ���״�߷��ӻ����д����ѧ����ʽ:________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и�ͼ�����������ȷ���ǣ������� 
A����ͼ��ʾH2��O2������Ӧ�����е������仯����H2��ȼ����Ϊ483.6kJmol��1
B����ͼ��ʾ���º��������·����Ŀ��淴Ӧ2NO2��g��N2O4��g���У������ʵ�Ũ��������������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬
C����ͼ��ʾ
A.B�����ʵ��ܽ�����¶ȱ仯�������A��B������Һ�ֱ���t1��������t2��ʱ�����ʵ�����������ΪA%=B%D����ͼ��ʾ�����£�ϡ��HA��HB�������ϡ��Һʱ����Һ��pH���ˮ���ı仯����ͬŨ�ȵ�NaA��Һ��pH����NaB��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼװ�ã���ɺܶ�绯ѧʵ�飮�����йش�װ�õ������У�����ȷ���ǣ������� 
A.��XΪп����YΪNaCl��Һ������K����M�����ɼ������ĸ�ʴ�����ַ�����Ϊ��������������������
B.��XΪ̼����YΪNaCl��Һ������K����N�����ɼ������ĸ�ʴ����Һ�е������������缫�ƶ�
C.��XΪͭ����YΪ����ͭ��Һ������K����M����ͭ�����������ӣ���ʱ���·�еĵ�����ͭ�缫�ƶ�
D.��XΪͭ����YΪ����ͭ��Һ������K����N�����������������ӣ���Һ��ͭ����Ũ�Ƚ���С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10 L�����ܱ������г���X(g)��Y(g)��������ӦX(g)��Y(g) ![]() M(g)��N(g)������ʵ���������±���
M(g)��N(g)������ʵ���������±���
ʵ�� ��� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | ||
n(X) | n(Y) | n(M) | |||
�� | 700 | 0.40 | 0.10 | 0.090 | |
�� | 800 | 0.10 | 0.40 | 0.080 | |
�� | 800 | 0.20 | 0.30 | a | |
�� | 900 | 0.10 | 0.15 | b | |
����˵����ȷ����(����)
A. ʵ�����У���5 minʱ���n(M)��0.050 mol����0��5 minʱ���ڣ���N��ʾ��ƽ����Ӧ����v(N)��1.0��10��2 mol��L��1��min��1
B. ʵ�����У��÷�Ӧ��ƽ�ⳣ��K��2.0
C. ʵ�����У��ﵽƽ��ʱ��X��ת����Ϊ60%
D. ʵ�����У��ﵽƽ��ʱ��b>0.060
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���ɫ��Ӧ�ı�����ȷ����
A.��ɫ��Ӧ�����ӵ���������
B.��ɫ��Ӧ�ǵ��ʵ���������
C.��ɫ��Ӧ��Ԫ�ص���������
D.��ɫ��Ӧ�ǻ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�������ص缫���϶���������̼������ش��������⣺

(1)��������о�ΪCuSO4��Һ����Ӧһ��ʱ���
���к�ɫ�����������Ǽ׳��е�________�����ҳ��е�________����(�Fe����C��)
���ҳ��е�������ӦʽΪ��________________��
���ҳ����ܷ�Ӧ�Ļ�ѧ����ʽΪ��________________��
(2)�������о�Ϊ����NaCl��Һ����Һ�е����η�̪��
���ҳ����ܵ����ӷ���ʽΪ��________________��
�ڼ׳�C���ϵĵ缫��ӦʽΪ��________________��
�ۼ׳������ȳ��ֺ�ɫ����_____�����ҳ������ȳ��ֺ�ɫ����______��(�Fe����C��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���3 mol A��1 mol B�����������ڹ̶��ݻ�Ϊ2 L���ܱ������У��������·�Ӧ��3A��g����B��g��![]() xC��g����2D��g����2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8 mol D�������C��Ũ��Ϊ0.2 mol��L��1�������жϴ������
xC��g����2D��g����2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8 mol D�������C��Ũ��Ϊ0.2 mol��L��1�������жϴ������
A. x��1
B. B��ת����Ϊ80%
C. 2 min��A��ƽ����Ӧ����Ϊ0.3 mol��(L��min)��1
D. �����������ܶȲ���������÷�Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com