
【题目】下列有关焰色反应的表述正确的是
A.焰色反应是离子的特有性质
B.焰色反应是单质的特有性质
C.焰色反应是元素的特有性质
D.焰色反应是化合物的特有性质
科目:高中化学 来源: 题型:
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-═IO3-+5I-+3H2O下列说法不正确的是( )
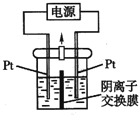
A. 右侧发生的电极方程式:2H2O+2e-═H2↑+2OH-
B. 电解结束时,右侧溶液中含有IO3-
C. 电解槽内发生反应的总化学方程式:![]()
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总反应不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计如下实验装置(图中夹持装置省略)测定制备的CaCO3粉末的纯度(样品中杂质不与酸反应,反应前装置中的CO2已全部排出)。下列说法错误的是
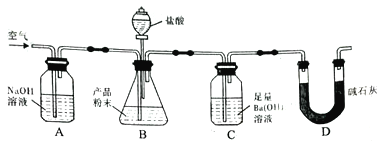
A. 缓入空气的作用是将反应结束后装置中残留的CO2全部鼓入到C装置中被吸收
B. A装置和D装置都是为了防止空气中的CO2气体进入C 装置而产生误差
C. 为了防止B 中盐酸挥发产生干扰,必须在B、C装置中间加一个装有饱和碳酸氢钠溶液的洗气瓶
D. 若CaCO3样品的质量为x,从C 中取出的沉淀洗净干燥后的质量为y,则CaCO3的纯度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将光敏染料(用S表示) 涂在纳米TiO2晶体(可导电) 表面制成其中一个电极,光敏染料可吸收光能将光敏染料S激发成敏化剂S* (高活性光敏材料)后发生下列相关反应:TiO2/S![]() TiO2/S*(激发态);TiO2/S*- e-→TiO2/S+ 2TiO2/S+ +3I-→2TiO2/S+I3-(注: S和S*不是硫单质,是光敏染料的代号)
TiO2/S*(激发态);TiO2/S*- e-→TiO2/S+ 2TiO2/S+ +3I-→2TiO2/S+I3-(注: S和S*不是硫单质,是光敏染料的代号)
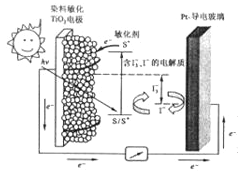
下列关于该太阳能电池叙述错误的是
A. 电池工作时,染料敏化的TiO2 电极为负极
B. 电池工作时,正极发生的反应为I3-+2e-=3I-
C. 电池工作过程中,光敏材料S→S*需要吸收能量,总反应中光敏材料S 不消耗
D. 该电池将光能直接转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,水的电离达到平衡:H2O![]() H+ + OH-。下列叙述正确的是
H+ + OH-。下列叙述正确的是
A. 将水加热,平衡向正反应方向移动,Kw不变
B. 向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大
C. 向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低
D. 向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)= c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图甲装置进行实验,若乙中横坐标x表示流入电极的电子的物质的量,下列叙述不正确的是( )
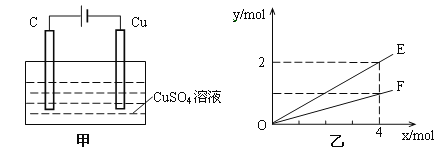
A. E表示生成铜的物质的量
B. E表示反应消耗水的物质的量
C. F表示反应生成氧气的物质的量
D. F表示生成硫酸的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4﹣环己二醇可通过下列路线合成(某些反应的反应物和反应条件未列出): 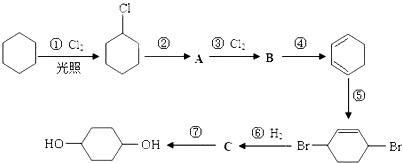
(1)写出反应④、⑦的化学方程式:④; ⑦ .
(2)②的反应类型是 , 上述七个反应中属于加成反应的有(填反应序号).
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同周期的X、Y、Z三种元素,已知最高价氧化物的水化物的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断错误的是
A. 非金属性: X>Y>Z
B. 气态氢化物的稳定性: HX>H2Y>ZH3
C. 原子半径: X>Y>Z
D. 阴离子的还原性: ![]() > X-
> X-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:
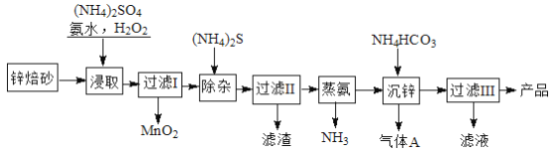
请回答下列问题:
(1)当(NH4)2SO4,NH3·H2O的混合溶液中存在c(NH4+)=2c(SO42-)时,溶液呈___________ (填“酸”、“碱”或“中”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是__________________(任写一种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为____________________________。
(4)“沉锌”的离子方程式为__________________________________。
(5)“过滤III”所得滤液可循环使用,其主要成分的化学式是__________________。
(6)己知:HCN的电离常数Ka=4.9×10 -10, H2S 的电离常数Ka1=1.3×10 -7,Ka2=7.0×10 -15,向NaCN 溶液中通入少量的H2S 气体,反应的离子方程式为______________________________________。在废水处理领域中常用H2S 将Mn2+转化为MnS 除去,向含有0.020 molL-1Mn2+废水中通入一定量的H2S 气体,调节溶液的pH=a,当HS-浓度为1.0×10 -4molL-1时,Mn2+开始沉淀,则a=____________。[已知: Ksp(MnS)=1.4×10 -15]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com