
【题目】1,4﹣环己二醇可通过下列路线合成(某些反应的反应物和反应条件未列出): 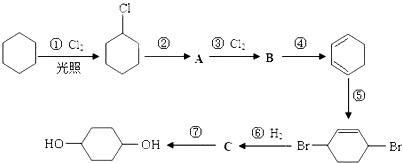
(1)写出反应④、⑦的化学方程式:④; ⑦ .
(2)②的反应类型是 , 上述七个反应中属于加成反应的有(填反应序号).
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为 .
科目:高中化学 来源: 题型:
【题目】如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题:
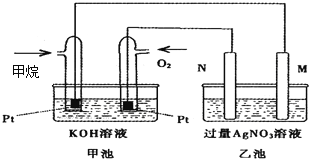
(1)M电极的材料是__________,其电极名称是_____________。
(2)N的电极反应式为____________________________,通入甲烷的电极反应式为______________________________________________,
(3)乙池总反应的化学方程式是_______________________________________________,
(4)在此过程中,乙池中某一电极析出金属银4.32g,甲池中理论上消耗氧气为_____mL(标准状况下),若此时乙池溶液的体积为400mL,则乙池中溶液的H+的浓度为__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,完成很多电化学实验.下列有关此装置的叙述中,不正确的是( ) 
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阳离子向铁电极移动
C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关焰色反应的表述正确的是
A.焰色反应是离子的特有性质
B.焰色反应是单质的特有性质
C.焰色反应是元素的特有性质
D.焰色反应是化合物的特有性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,合成氨反应的热化学方程式为:N2 (g) +3H2 (g)![]() 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
下列叙述正确的是
A. 混合气体的质量不变时,说明该反应一定达到平衡状态
B. 将容器的体积扩大到原来的二倍,υ(正)减小,υ(逆)增大,平衡向左移动
C. 催化剂既能提高N2的转化率,又能缩短达到平衡所需时间,提高生产效益
D. 在密闭容器中放入1 mol N2和3 mol H2进行反应,测得反应放出的热量小于92.4 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两电池电极材料都是铁棒与碳棒,请回答下列问题:

(1)若两电池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒.(填“Fe”或“C”)
②乙池中的阳极反应式为:________________.
③乙池中总反应的化学方程式为:________________.
(2)若两池中均为饱和NaCl溶液,溶液中滴两滴酚酞.
①乙池中总的离子方程式为:________________.
②甲池C极上的电极反应式为:________________.
③甲池中首先出现红色的是_____极;乙池中首先出现红色的是______极(填“Fe”或“C”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度会影响微生物的生存和繁殖.下表为大肠杆菌在不同温度下繁殖l代所用的时间(min).根据表格可直接得出哪项结论( )
温度 | 10℃ | 15℃ | 20℃ | 25℃ | 30℃ | 35℃ | 40℃ | 45℃ | 50℃ | ||
时间 | 860 | 120 | 90 | 40 | 29 | 22 | 1 | 5 | 2 | 0 | 80 |
A.10℃时细菌繁殖最快 B.温度越高酶活性越强
C.低温可抑制细菌繁殖 D.酶的活性受时间控制
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnCO3可用于制备活性电极材料MnO2。以菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料制备碳酸锰粗产品的流程如下:
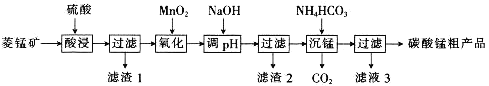
已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
(1)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_________________________________。
(2)用离子方程式表示“氧化”过程中加MnO2的目的:_______________________________。
(3)“调pH”时,向含有硫酸铁和硫酸铝的混合溶液中滴加氢氧化钠溶液至两种沉淀共存,当c(Fe3+)=1.0×10-5mol·L-1时,c(Al3+)=______________mol·L-1。
(4)①“沉锰”过程中,反应的离子方程式为_____________________。
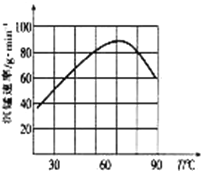
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是_____________________________。
(5)从滤液3中可分离出一种不含碳元素的氮肥,它的化学式为_____________________________。
(6)工业上,可以将碳酸锰制成硫酸锰,再用惰性电极电解酸性硫酸锰溶液来制备活性二氧化锰,电解时的阳极反应式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明微量元素是生命活动所必需的是下列哪项( )
A. Mg是叶绿素的组成成分
B. 哺乳动物血液中Ca2+含量太低,会抽搐
C. 油菜缺少B时只会开花不结果
D. Ca2+缺少时,会影响骨髓的发育
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com