
【题目】同周期的X、Y、Z三种元素,已知最高价氧化物的水化物的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断错误的是
A. 非金属性: X>Y>Z
B. 气态氢化物的稳定性: HX>H2Y>ZH3
C. 原子半径: X>Y>Z
D. 阴离子的还原性: ![]() > X-
> X-
科目:高中化学 来源: 题型:
【题目】己二酸是一种重要的有机二元酸,能够发生成盐反应、酯化反应、酰胺化反应等,并能与二元胺或二元醇缩聚成高分子聚合物等,是合成尼龙-66的原料,工业上环己醇用硝酸氧化可得到己二酸,是典型的氧化还原反应。
 △H<0
△H<0
相关物理常数:
名称 | 相对分子质量 | 密度(20℃) g/cm3 | 熔点(℃) | 沸点(℃) | 溶解度S(g100g溶剂) | ||
水 | 乙醇 | 乙醚 | |||||
环己醇 | 100 | 0.96 | 25.2 | 161 | 可溶 | 易溶 | |
己二酸 | 146 | 1.36 | 151 | 265 | 可溶(S随温度降低而减小) | 易溶 | 微溶 |
I.己二酸粗产品的制备
操作步骤:装置C中加入50mL中等浓度的硝酸(过量),投入沸石,并逐一安 装装置A、装置B和温度计,磁力搅拌,将溶液混合均匀,并加热到80℃。用装置A滴加2滴环己醇,反应立即开始,温度随即上升到85~90℃,从装置A中小心地逐滴加入环己醇,将混合物在85-90℃下加热2-3 分钟,共加入1.000g环己醇。
请回答下列问题:

(1)反应需维持温度在85~90℃,最好采取______控温;试分析维持温度在85~90℃的原因:__________。
(2) 装置右侧烧杯中的NaOH 溶液的作用是:_______________。
II.己二酸粗产品的提纯及应用
操作流程:趁热倒出装置C 中的产品,在冷水中降温冷却,析出的晶体在布氏漏斗上进行抽滤,将晶体进行重结晶,再分别用3mL 冰水和乙醚洗涤己二酸晶体,继续抽滤,晶体再用3mL冰水洗涤一次,再抽滤。取出产品,干燥后称重,得干燥的己二酸0.860g。
请回答下列问题:
(3) 相比于普通过滤,抽滤的优点在于:_________
(4)在抽滤过程中,用冰水洗涤析出的己二酸晶体的原因:___________。
(5)该实验的产率为: _______% (结果保留3 位有效数字)
(6)工业上用己二酸与乙二醇反应形成链状高分子化合物,写出化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关焰色反应的表述正确的是
A.焰色反应是离子的特有性质
B.焰色反应是单质的特有性质
C.焰色反应是元素的特有性质
D.焰色反应是化合物的特有性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两电池电极材料都是铁棒与碳棒,请回答下列问题:

(1)若两电池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒.(填“Fe”或“C”)
②乙池中的阳极反应式为:________________.
③乙池中总反应的化学方程式为:________________.
(2)若两池中均为饱和NaCl溶液,溶液中滴两滴酚酞.
①乙池中总的离子方程式为:________________.
②甲池C极上的电极反应式为:________________.
③甲池中首先出现红色的是_____极;乙池中首先出现红色的是______极(填“Fe”或“C”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度会影响微生物的生存和繁殖.下表为大肠杆菌在不同温度下繁殖l代所用的时间(min).根据表格可直接得出哪项结论( )
温度 | 10℃ | 15℃ | 20℃ | 25℃ | 30℃ | 35℃ | 40℃ | 45℃ | 50℃ | ||
时间 | 860 | 120 | 90 | 40 | 29 | 22 | 1 | 5 | 2 | 0 | 80 |
A.10℃时细菌繁殖最快 B.温度越高酶活性越强
C.低温可抑制细菌繁殖 D.酶的活性受时间控制
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d、e的原子序数依次增大,b是地壳中含量最高的元素,e的单质的熔点在同周期元素中最高,a、b的原子序数之和等于e的原子序数,d原子的核外电子层数等于最外层电子数:分别向cdb2溶液、c2eb3溶液中通入气体ab2,产生沉淀的质量与通入气体的体积的定性关系都可用右图表示。下列说法不正确的是
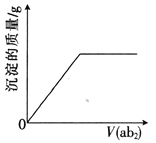
A. 原子半径:c>d>e>a>b
B. 工业上通常采用ab高温还原d2b3的方法冶炼d的单质
C. 同温下,0.1mol·L-1c2eb3溶液的pH大于0.1mol·L-1c2ab3溶液
D. 简单氢化物的热稳定性:b>a>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnCO3可用于制备活性电极材料MnO2。以菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料制备碳酸锰粗产品的流程如下:
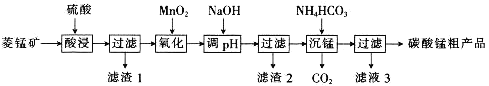
已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
(1)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_________________________________。
(2)用离子方程式表示“氧化”过程中加MnO2的目的:_______________________________。
(3)“调pH”时,向含有硫酸铁和硫酸铝的混合溶液中滴加氢氧化钠溶液至两种沉淀共存,当c(Fe3+)=1.0×10-5mol·L-1时,c(Al3+)=______________mol·L-1。
(4)①“沉锰”过程中,反应的离子方程式为_____________________。
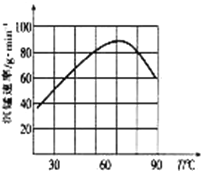
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是_____________________________。
(5)从滤液3中可分离出一种不含碳元素的氮肥,它的化学式为_____________________________。
(6)工业上,可以将碳酸锰制成硫酸锰,再用惰性电极电解酸性硫酸锰溶液来制备活性二氧化锰,电解时的阳极反应式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
A. x=1
B. B的转化率为80%
C. 2 min内A的平均反应速率为0.3 mol·(L·min)-1
D. 若混合气体的密度不变则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生理盐水是指质量分数为0.9%的NaCl溶液.下列有关该溶液说法正确的是( )
A.100g溶液中含有0.9 g NaCl
B.100 g水中含有0.9 g NaCl
C.100 g溶液中含有0.9 mol NaCl
D.100 g水中含有0.9 mol NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com