
【题目】E、M、N、Q都是短周期元素,其原子序数依次增大。E原子核内仅含有1个质子;M原子的最外层电子数是次外层的3倍;N的原子半径是短周期元素中最大的;N与Q能够形成NQ型离子化合物。下列说法错误的是
A. 四种元素中只有一种是金属元素 B. Q的最高化合价为+7
C. N的最高价氧化物对应的水化物是一种强碱 D. 离子半径:M<N
【答案】D
【解析】E原子核内仅含有1个质子,E为H元素;M原子的最外层电子数是次外层的3倍,M为O元素;N的原子半径是短周期中最大的,N为Na元素;N与Q能形成NQ型离子化合物,Q的原子序数大于N,Q为Cl元素。
E原子核内仅含有1个质子,E为H元素;M原子的最外层电子数是次外层的3倍,M为O元素;N的原子半径是短周期中最大的,N为Na元素;N与Q能形成NQ型离子化合物,Q的原子序数大于N,Q为Cl元素。A项,四种元素中只有N(Na)是金属元素,A项正确;B项,Q为Cl元素,Cl原子最外层有7个电子,Q的最高化合价为+7,B项正确;C项,N的最高价氧化物对应的水化物为NaOH,NaOH是一种强碱,C项正确;D项,M、N的离子依次为O2-、Na+,根据“序大径小”,离子半径M![]() N,D项错误;答案选D。
N,D项错误;答案选D。


科目:高中化学 来源: 题型:
【题目】烟气脱硫能有效减少二氧化硫的排放。目前最常用的脱硫技术是湿法石灰石—石膏脱硫,即利用石灰石和烟气中的SO2反应生成石膏一脱除SO2。某研究性学习小组在实验室利用如图所示装置制备模拟烟气(主要成分为SO2、CO2、N2、O2),并测定烟气中SO2的体积分数以及研究烟气通过转化器的脱硫效率。回答下列问题:
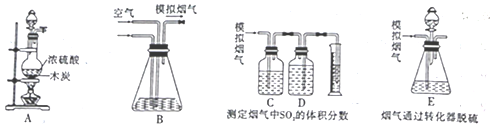
Ⅰ.模拟烟气的制备。
(1)装置 A中盛装浓硫酸的仪器名称是_____________,写出装置A中发生反应的化学方程式:________。
Ⅱ.测定烟气中SO2的体积分数。
(2)已知装置C、D中盛有的药品分别是酸性KMnO4溶液、饱和NaHCO3溶液,写出装置C的作
用:_______________,装置D中饱和NaHCO3溶液中的离子浓度由大到小的关系为_____________。
(3)①甲同学认为应该在装置C、D之间增加一个盛有品红溶液的洗气瓶,理由是_____________。
②乙同学根据模拟烟气的流速a mL/min和t1分钟后测得的量筒内液体的体积VmL,计算烟气中二氧化硫的体积分数。为保证准确读取量筒读数应注意:a.将装置冷却至室温;b._________;c.平视。
Ⅲ.模拟烟气通过转化器的脱硫效率研究。
(4)将模拟烟气通过装置E,其中盛有FeCl2、FeCl3的混合溶液,它可以催化SO2与氧气的反应以达到脱硫的目的。写出催化剂参与反应过程中的离子方程式:SO2+2H2O+2Fe3+=SO42-+2Fe2++4H+、____________。
(5)若模拟烟气仍以amL/min的流速通过转化器E装置,t2分钟后,向E装置中加入酸化的BaCl2溶液,得到白色浑浊液,经过滤、洗涤、干燥、称量,得到m g固体。若实验测得的气体体积已折算为标准状况下的体积,则该转化器的脱硫效率是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃酚是生产呋喃丹、好安威等农药的主要中间体,是高附加值的精细化工产品.一种以邻氯苯酚(A)为主要原料合成呋喃酚(F)的流程如下:
![]()

回答下列问题:
(1)A 物质核磁共振氢谱共有 个峰,④的反应类型是 ,C和D中含有的相同官能团的名称是 .
(2)下列试剂中,能和D反应的有 (填标号).
A.溴水 B.酸性K2Cr2O7溶液 C.FeC12溶液 D.纯碱溶液
(3)写出反应①的化学方程式是 (有机物用结构简式表示,下同).
(4)有机物B可由异丁烷经三步反应合成:异丁烷![]() X
X![]() Y
Y![]()
![]() 有机物B条件a为 ,Y生成B的化学方程式为 .
有机物B条件a为 ,Y生成B的化学方程式为 .
(5)呋喃酚的同分异构体很多,写出符合下列条件的所有同分异构体的结构简式
①苯环上的一氯代物只有一种
②能发生银镜反应的芳香酯.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废液主要成分为SiO2、FeO、Fe2O3、Al2O3 等,为综合利用,对其进行如下处理,制备Al2O3及(NH4)2Fe(SO4)2·6H2O。

相关数据如下:
Kb(NH3·H2O) | 1.8×10-5 | 溶解度/g | 10℃ | 30℃ | 50℃ |
Ksp[A1(OH)3] | 1.3×10-33 | (NH4)2SO4 | 73.0 | 78.0 | 84.5 |
Ksp[Fe(OH)2] | 8.0×10-16 | FeSO4·7H2O | 40.0 | 60.0 | |
Ksp[Fe(OH)3] | 4.0×10-38 | |(NH4)2Fe(SO4)2·6H2O | 18.1 | 24.5 | 31.3 |
(1)酸浸过程中产生的滤渣的主要成分是_______________。
(2)滤液①中加入铁粉的作用是__________________。
(3)已知加入氨水前,溶液中H+、Fe2+、Al3+的浓度分别为0.02 mol/L、0.16mol/L、0.04mol/L,加人氨水后,溶液的体积刚好增加1倍。为防止Fe2+ 产生沉淀,则溶液中的pH不能超过_______,此时溶液中n(NH3·H2O):n(NH4+)≤_____________;若调节溶液pH为5,则溶液中所有离子的物质的量浓度由大到小排列的顺序是_________________。
(4)由滤液②制备(NH4)2Fe(SO4)2·6H2O 晶体时,为防止有(NH4)2SO4或FeSO4晶体析出,须先向滤液②中加人适量的______________,再蒸发浓缩、__________、过滤、__________、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法,正确的是( ) 
A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL 稀HNO3和稀H2SO4组成的混合溶液中,两种酸的物质的量浓度之和为0.4mol/L.向该溶液中加入足量的铜粉后加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为(反应前后溶液体积变化忽略不计)
A. 0.15mol/L B. 0.24mol/L C. 0.30mol/L D. 0.36mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
①2HI(g)![]() I2(g)+H2(g) △H=+9.48kJ·molˉ1
I2(g)+H2(g) △H=+9.48kJ·molˉ1
②2HI(g)![]() I2(s)+H2(g) △H=-26.48kJ·molˉ1
I2(s)+H2(g) △H=-26.48kJ·molˉ1
下列说法中正确的是
A. ①的反应物比②的反应物稳定
B. I2(s)=I2(g)△H=-35.96 kJ·mol-1
C. ①的产物总能量比②的产物总能量高
D. 1mol I2(s)中通入1mol H2(g),充分反应时吸收26.48kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国新修订的《环境保护法》,使环境保护有了更严格的法律依据.
①为减少煤燃烧时二氧化硫的排放,对煤炭进行处理(填专有名词),同时对燃煤的烟气进行处理(填专有名词),防止造成雾霾天气.
②含铬元素的废水必须治理达标.某兴趣小组处理含Cr2O72﹣的废水的方法是用(NH4)2Fe(SO4)2将其还原为Cr3+ , 再用氨水将Cr3+转变成难溶的Cr(OH)3 . 写出用氨水将Cr3+转变成难溶的Cr(OH)3的离子方程式:;该方案处理后的废水中因含有大量元素,导致水体富营养化.
③将CO2和H2按物质的量1:4混合,在适当条件下反应可获得CH4 . 写出该反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用元素周期律解释的是( )
A.碱性:NaOH>Al(OH )3B.酸性:HClO4>HIO4
C.相对原子质量:Ar>KD.稳定性:H2O>H2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com