
【题目】下列关于水的电离平衡的相关说法正确的是( )
A. c(H+)=![]() 的溶液一定呈中性
的溶液一定呈中性
B. 将水加热,Kw增大,pH增大,仍呈中性
C. 向0.1mol/L醋酸溶液中加水,溶液中水电离产生的c(H+)将减小
D. 向水中加入少量碳酸氢钠固体,溶液的c(H+)增大,平衡逆向移动
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的正确组合是( )
A.碱:Na2CO3 酸: H2SO4 盐: NaHCO3 碱性氧化物: SiO2 酸性氧化物: CO2
B.碱:NaOH 酸: HCl 盐: NaCl 碱性氧化物: Na2O 酸性氧化物: CO
C.碱:NaOH 酸: CH3COOH 盐: CaF2 碱性氧化物: SO3 酸性氧化物: SO2
D.碱:KOH 酸: HNO3 盐: CaCO3 碱性氧化物: CaO 酸性氧化物: SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,用表中①~⑨的元素符号或物质化学式回答问题:
族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ||||||||
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)元素⑥的原子的核外电子数为_______,原子的L层电子数是K层2倍的元素为
_______(填元素符号);
(2)化学性质最不活泼的元素原子的原子结构示意图为____________;
(3)①~⑧中,元素原子半径最大的是________(填元素符号),这些元素的最高价氧化物对应的水化物中,酸性最强的酸是________(填化学式);
(4)请写出元素⑤的过氧化物的电子式______________;
(5)用电子式表示元素②的氢化物的形成过程________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图甲装置进行实验,若乙中横坐标x表示流入电极的电子的物质的量,下列叙述不正确的是( )

A.E表示生成铜的物质的量 B.E表示总反应中消耗水的物质的量
C.F表示生成硫酸的物质的量 D.F表示反应生成氧气的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,按要求填空(均填元素符号或化学式):
周期 族 | IA | IIA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
4 | ⑩ |
(1)⑧位于元素周期表中第_______周期第_______ 族。
(2)在这些元素中,最活泼的非金属元素是______(填元素符号);元素的最高价氧化物对应水化物中,碱性最强的是______(填化学式)。
(3)④的单质和②的单质在点燃条件下生成物的电子式是_______;⑨的气态氢化物和溴化氢相比,较稳定的是___________(写化学式)。
(4)⑥与⑨形成的化合物和水反应,生成一种弱酸和一种强酸,该反应的化学方程式是________________。
(5)元素①的气态氢化物与其最高价氧化物的水化物反应的化学方程式_________________。
(6)⑨的单质与⑩的最高价氧化物的水化物反应的离子方程式为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生取某物质溶于水,制得无色透明溶液,进行以下实验:①与碱反应生成盐和水;②该溶液中阳离子只有H+;③与铁反应生成氢气。根据你学过的酸的概念,其中能说明该物质为酸类物质的是:
A.①②③ B.①② C.② D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1
将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。图中数据a(1,6)表示:在1 min时H2的物质的量是6 mol。
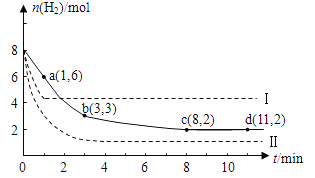
(1)a点正反应速率 (填“大于”“等于”或“小于”)逆反应速率。计算其化学平衡常数K=
(2)下列时间段平均反应速率最大的是
A.O~1 min B.1~3 min C.3~8 min D.8~11 min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 。
(4)锰酸锂、钛酸锂都是绿色环保新型能源材料,可以用MnO2为原料制取锰酸锂。
①以石墨为电极,电解酸化的MnSO4溶液可制备MnO2,则阳极的电极反应式为 。
②MnO2是碱性锌锰电池的正极材料.碱性锌锰电池放电时,正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
A.②④⑤⑥ B.①② C.②③⑤ D.②④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com