
| A | ①能使溴的四氯化碳溶液褪色; ②填充模型为 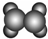 ; ;③能与水在一定条件下反应生成C. |
| B | ①由C、H两种元素组成; ②球棍模型为 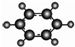 . . |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成一种有香味的油状物. |
| D | ①由C、H、O三种元素组成; ②球棍模型为 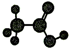 . . |
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$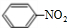 +H2O.
+H2O.分析 由表格中的信息可知,A为CH2=CH2,A与水加成生成C,C为CH3CH2OH,由B的球棍模型可知,B为苯,由D的球棍模型可知D为CH3CHCOOH,C与D酯化反应生成E,E为CH3CHCOOCH2CH3,然后结合有机物的性质来解答.
解答 解:由表格中的信息可知,A为CH2=CH2,A与水加成生成C,C为CH3CH2OH,由B的球棍模型可知,B为苯,由D的球棍模型可知D为CH3CHCOOH,C与D酯化反应生成E,E为CH3CHCOOCH2CH3,
(1)A为CH2=CH2,与溴发生加成反应生成A为CH2BrCH2Br,与水发生加成反应生成乙醇,方程式为A为CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH,
故答案为:CH2BrCH2Br;CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH;
(2)A为CH2=CH2,A与氢气发生加成反应后生成物质E为乙烷,烷烃的通式CnH2n+2,当n=4时,即丁烷开始出现同分异构体,
故答案为:C;
(3)B为苯,密度比水小,有毒,不溶于水,与高锰酸钾、溴水不反应,可在一定条件下与氢气发生加成反应,在浓硫酸作用下,苯与浓硝酸反应的化学方程式为 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$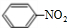 +H2O,
+H2O,
故答案为:B; +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$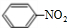 +H2O;
+H2O;
(4)C与D发生酯化反应反应生成乙酸乙酯,也为取代反应,故答案为:乙酸乙酯;取代反应或酯化反应.
点评 本题考查有机物的推断、有机物结构与性质等,注意根据结构模型推断有机物,注意掌握官能团的性质与转化是关键,旨在考查学生对基础知识的掌握.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
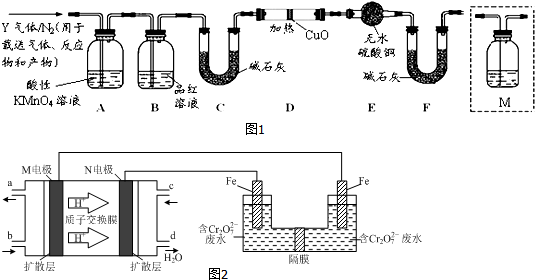
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2015年科学家首次利用X射线观测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生成CO2分子. 下列关于说法正确的是( )
2015年科学家首次利用X射线观测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生成CO2分子. 下列关于说法正确的是( )| A. | CO与CO2均为酸性氧化物 | |
| B. | 大量CO2的排放可导致酸雨的形成 | |
| C. | CO与O形成化学键过程中有电子转移 | |
| D. | 相同条件下,CO的密度比CO2的密度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 10种 | C. | 12种 | D. | 多于12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加KI溶液时,转移2 mol e-时生成 1 mol白色沉淀 | |
| B. | 通入SO2后溶液逐渐变成无色,不是 SO2的漂白性 | |
| C. | 通入SO2时,SO2与I2反应,I2作氧化剂 | |
| D. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
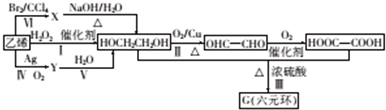
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com