
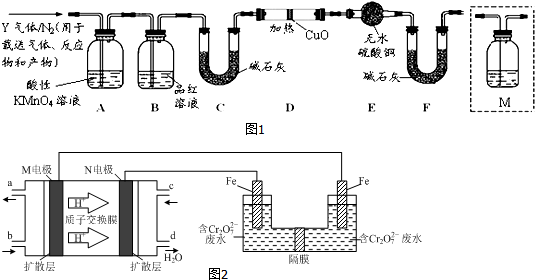
分析 (1)常温下,铁遇冷的浓硫酸发生钝化现象;
(2)①浓硫酸变稀硫酸和铁反应生成硫酸亚铁,也可能是铁过量和生成的铁盐生成亚铁盐,亚铁离子有还原性,能还原酸性高锰酸钾溶液而使其褪色,遇到K3[Fe(CN)6]溶液计划生成蓝色溶液是亚铁离子的特征性质;
②根据硫酸钡与二氧化硫的关系式计算二氧化硫的体积,再根据体积分数公式计算;
(3)二氧化硫能使品红溶液褪色,据此判断是否含有二氧化硫;
(4)碳素钢中含有碳,加热条件下,碳和浓硫酸反应生成二氧化碳、二氧化硫和水;
(5)用澄清石灰水检验二氧化碳,首先要排除二氧化硫的干扰;
(6)Q1气体,在标准状况下,密度为0.0893g•L-1,其相对分子质量为2,所以是氢气,氢气检验还原性,能含有氧化铜同时生成水,水能使无水硫酸铜变蓝.
解答 解:(1)常温下,铁遇冷的浓硫酸发生氧化还原反应,在铁表面生成一层致密的氧化物薄膜而阻止了进一步的反应,即发生钝化现象,常温下,工业上可用铁质容器盛放冷的浓硫酸,
故答案为:铁在冷的浓硫酸中钝化,表面生成致密氧化膜;
(2)①甲同学认为X中除Fe3+之外还可能含有Fe2+,产生Fe2+的反应是浓硫酸变稀后铁稀硫酸生成,或生成铁离子和过量铁反应生成,反应的离子方程式为:Fe+2H+=Fe2++H2↑或2Fe3++Fe=3Fe2+,亚铁离子具有还原性,而酸性高锰酸钾有氧化性,发生氧化还原反应使高锰酸钾溶液褪色,亚铁离子与K3[Fe(CN)6]溶液计划生成蓝色溶液是亚铁离子的特征性质,故选cd,
故答案为:Fe+2H+=Fe2++H2↑或2Fe3++Fe=3Fe2+;cd;
②SO2+Br2+2H2O=2HBr+H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,所以硫酸钡和二氧化硫之间的关系式为SO2-----BaSO4,设二氧化硫的体积为V,
SO2-----BaSO4,
22.4L 233g
V 4.66g
V=0.448l=448mL,
所以二氧化硫的体积分数=$\frac{448ml}{560ml}$×100%=80%,
故答案为:80%;
(3)二氧化硫能使品红溶液褪色,所以用品红溶液检验二氧化硫是否除尽,故答案为:检验SO2是否除尽;
(4)碳素钢中含有碳,加热条件下,碳能和浓硫酸反应生成二氧化硫、二氧化碳和水,反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(5)二氧化硫和二氧化碳都能使澄清石灰水变浑浊,但二氧化硫还能使品红溶液褪色,所以要检验二氧化碳必须排除二氧化硫的干扰,B装置是检验二氧化硫是否除尽,所以澄清石灰水应放置在B和C之间,故选c,
故答案为:c;
(6)氢气具有还原性,能还原性,能还原黑色的氧化铜生成红色的铜单质,同时生成水,水能使无水硫酸铜变蓝色,这是检验水的特征反应,所以如果D中氧化铜变红,E中无水硫酸铜变蓝,则证明含有氢气,
故答案为:D中氧化铜变红,E中无水硫酸铜变蓝.
点评 本题考查了浓硫酸的性质、二氧化硫的性质、常见物质的检验等知识点,注意常温下,铁和冷的浓硫酸不是不反应,而是反应生成了致密的氧化物薄膜而阻止了进一步反应,为易错点,题目难度中等.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯中含乙酸杂质:加入饱和碳酸钠溶液洗涤,分液 | |
| B. | 乙醇中含乙酸杂质:加入碳酸钠溶液洗涤,分液 | |
| C. | 乙醛中含乙酸杂质:加入氢氧化钠溶液洗涤,分液 | |
| D. | 苯中含苯酚杂质:加入浓溴水,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
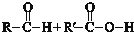 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$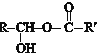
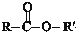 $?_{△}^{催化剂}$
$?_{△}^{催化剂}$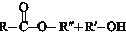
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 回答下列问题:
回答下列问题: ,乙的电子式为
,乙的电子式为 .
.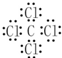 ,乙的化学式为NaCl.
,乙的化学式为NaCl.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | ①能使溴的四氯化碳溶液褪色; ②填充模型为 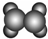 ; ;③能与水在一定条件下反应生成C. |
| B | ①由C、H两种元素组成; ②球棍模型为 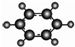 . . |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成一种有香味的油状物. |
| D | ①由C、H、O三种元素组成; ②球棍模型为 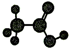 . . |
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$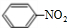 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbO2是电池的负极 | |
| B. | 负极的电极反应式为:Pb+SO42--2e-═PbSO4 | |
| C. | 铅蓄电池放电时,每转移2mol电子时消耗1mol硫酸 | |
| D. | 电池放电时,两极质量均增加,且每转移1mol电子时正极质量增加48g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 3 | C. | 2 | D. | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com