
【题目】下列说法正确的是( )
A.酸雨是指pH小于7的降水
B.水泥、玻璃、水晶饰物和珍珠都是硅酸盐制品
C.城市空气质量报告中包括PM2.5、SO2、NO2、CO2等污染物
D.钢是用量最大、用途最广的合金,青铜是我国历史上最早使用的合金
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于常见有机物的说法正确的是
A. 煤的干馏可得煤油,乙烯和苯能通过石油分馏得到
B. 油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离
C. 构成蛋白质的基本单元是氨基酸,构成核酸的基本单元是核甘酸
D. 分子式为C3H8O的有机物,发生消去反应能生成2种烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 向AgNO3溶液中滴加氨水至过量:Ag++NH3·H2O=AgOH↓+NH4+
B. 向海带灰浸出液中加入硫酸、双氧水;2I-+2H++H2O2=I2+2H2O
C. 向Na2S2O3溶液中加入足量稀硫酸;2S2O32-+4H+=SO42-+3S↓+2H2O
D. 向苯酚钠溶液中通入少量CO2气体:2![]() +CO2+H2O→2
+CO2+H2O→2![]() +CO32-
+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在生产生活中应用十分广泛.请回答下列问题: 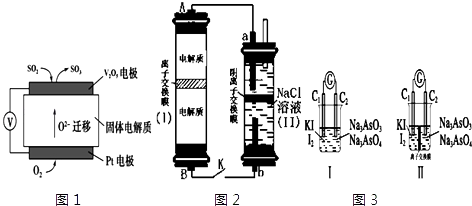
(1)通过SO2传感器可监测大气中SO2的含量,其工作原理如图1所示. ①固体电解质中O2﹣向极移动(填“正”或“负”).
②写出V2O5电极的电极反应式: .
(2)如图2所示装置I是一种可充电电池,装置Ⅱ是一种以石墨为电极的家用环保型消毒液发生器.装置I中离子交换膜只允许Na+通过,充放电的化学方程式为:2Na2S2+NaBr3 ![]() Na2S4+3NaBr ①负极区电解质为:(用化学式表示)
Na2S4+3NaBr ①负极区电解质为:(用化学式表示)
②家用环保型消毒液发生器发生反应的离子方程为 .
③闭合开关K,当有0.04mol Na+通过离子交换膜时,a电极上析出的气体在标准状况下体积为mL.
(3)如图3Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43﹣+2I﹣+2H+AsO33﹣+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸或40%NaOH溶液,电流表指针都不发生偏转;乙组经思考后先添加了一种离子交换膜,然后向图Ⅱ烧杯右侧中逐滴加入适量浓盐酸或适量40%NaOH溶液,发现电流表指针都发生偏转. ①甲组电流表指针都不发生偏转的原因是 .
②乙组添加的是(填“阴”或“阳”)离子交换膜.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义.
(1)①硫离子的结构示意图为 . ②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 .
(2)25℃,在0.10molL﹣1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2﹣)关系如图(忽略溶液体积的变化、H2S的挥发). 
①pH=13时,溶液中的c(H2S)+c(HS﹣)=molL﹣1 .
②某溶液含0.020molL﹣1Mn2+、0.10molL﹣1H2S,当溶液PH=时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10﹣13]
(3)25℃,两种酸的电离平衡常数如表.
Ka1 | Ka2 | |
H2SO3 | 1.3×10﹣2 | 6.3×10﹣8 |
H2CO3 | 4.2×10﹣7 | 5.6×10﹣11 |
①HSO3﹣的电离平衡常数表达式K= .
②0.10molL﹣1Na2SO3溶液中离子浓度由大到小的顺序为 .
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题. 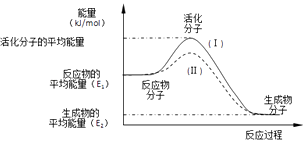
(1)图中所示的反应是(填“吸热”或“放热”)反应,该反应的△H=kJ/mol(用含E1、E2的代数式表示).
(2)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能明显降低,活化分子百分数增多,反应速率加快,你认为最有可能的原因是 .
(3)0.01mol甲苯(分子式为C7H8 , 常温下为液态)在足量的O2中燃烧,生成CO2气体和液态水,放出39.43kJ的热量.该反应的热化学方程式为: .
(4)将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一.煤转化为水煤气的主要化学反应为:C(s)+H2O(g)═CO(g)+H2(g);焓变为△H1 . 已知:①2H2(g)+O2(g)═2H2O(g);△H2=﹣483.6kJ/mol
②2C(s)+O2(g)═2CO(g);△H3=﹣221.0kJ/mol结合上述热化学方程式计算得出△H1=kJ/mol
(5)计算△H1时所用到的基本化学规律叫做定律.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向VmL pH=a的醋酸中滴加pH=b的NaOH溶液VmL时,两者恰好完全反应,下列说法正确的是( )
A.此时a+b的值是大于14
B.反应后溶液呈中性
C.反应后溶液中由水电离的c(H+)小于10﹣7mol/L
D.反应前醋酸和NaOH对水的电离影响程度一样
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】达康书记又追问环保局长:那么垃圾处理中,能随便焚烧吗?焚烧垃圾会降低GDP的。在焚烧垃圾过程中发生了( )
A.吸热的氧化还原反应
B.吸热的非氧化还原反应
C.放热的氧化还原反应
D.放热的非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知固体A受热易分解,实验流程和结果如下:

B和C为常见气体且所含元素相同。气体C在标准状况下密度为1.96g·L-1。请回答:
(1)白色沉淀的化学式___________________。
(2)写出A受热分解的化学方程式___________________。
(3)取少量固体D溶于稀硫酸,加入适量的KI溶液,反应后溶液显棕黄色,同时产生一种白色的碘化物沉淀。写出产生该现象的离子方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com