
【题目】在给定条件下,下列选项所示物质间满足每一步转化均能实现的是( )
A.N2(g)![]() NO(g)
NO(g) ![]() NaNO2(aq)
NaNO2(aq)
B.NaCl(aq) ![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
C.![]()
D.Fe3O4(s) ![]() Fe(s)
Fe(s) ![]() Fe(NO3)3(aq)
Fe(NO3)3(aq)
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】氮元素可以形成多种氢化物,如NH3、N2H4等。
(1)工业上,可用次氯酸钠与氨反应制备N2H4(肼),副产物对环境友好,写出反应的化学方程式________。
(2)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如图所示:
CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如图所示:

①该反应的ΔH_____0(填“>”或“<”)。
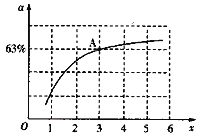
②已知原料气中的氨碳比[![]() ]为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如图所示。a随着x的增大而增大的原因是______。图中A点处,NH3的平衡转化率为__________。
]为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如图所示。a随着x的增大而增大的原因是______。图中A点处,NH3的平衡转化率为__________。
(3)①在氨水加水稀释的过程中,NH3·H2O的电离程度增大,![]() 的值_______。(填“增大”、“减小”或“不变”,)
的值_______。(填“增大”、“减小”或“不变”,)
②室温下,amol/L的(NH4)2SO4溶液的pH=5,原因是_____(用离子方程式表示),该反应的平衡常数为______(用含a的数学表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
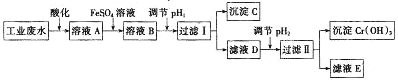
【题目】工业上用含有![]() 和
和![]() 的废水回收铬.其工艺流程如图:
的废水回收铬.其工艺流程如图:
已知:![]() 黄色
黄色![]() 橙色
橙色![]() ;
;
![]() 常温下,
常温下,![]() ,
,![]() ;
;
![]() 当离子浓度小于
当离子浓度小于![]()
![]() 时,认为沉淀完全.
时,认为沉淀完全.
![]() 酸化后的溶液A显 ______ 色.
酸化后的溶液A显 ______ 色.
![]() 下列选项中,能说明反应
下列选项中,能说明反应![]() 黄色
黄色![]() 橙色
橙色![]() 达到平衡状态的是 ______
达到平衡状态的是 ______ ![]() 填选项字母
填选项字母![]() ;
;
![]() 和
和![]() 的浓度相同
的浓度相同![]() 溶液的颜色不变
溶液的颜色不变![]() 溶液的pH不变
溶液的pH不变
![]() 为防止
为防止![]() 溶液变质,在保存时需加入的试剂为 ______
溶液变质,在保存时需加入的试剂为 ______ ![]() 填试剂名称
填试剂名称![]() .
.
![]() 过滤操作中需要用到的玻璃仪器有 ______ .
过滤操作中需要用到的玻璃仪器有 ______ .
![]() 溶液与溶液A发生反应的离子方程式为 ______ .
溶液与溶液A发生反应的离子方程式为 ______ .
![]() 沉淀C的化学式为 ______ ,
沉淀C的化学式为 ______ ,![]() 的范围为 ______ .
的范围为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握化学的基本概念和研究方法才能学好化学。按要求回答下列问题:
(1)下列是对碱、酸、盐、氧化物的分类列表:
碱 | 酸 | 盐 | 氧化物 | |
第一组 |
|
|
|
|
第二组 |
|
|
|
|
第三组 |
|
|
|
|
表中每组均有物质分类错误,三组中对应分类错误的物质分别是_________、_________、_________。(填化学式)
(2)![]() 固体不能导电,而
固体不能导电,而![]() 溶液可以导电,原因是_________________________。
溶液可以导电,原因是_________________________。
(3)依据下列两个反应,按要求填空。
Ⅰ.![]()
Ⅱ.![]()
反应Ⅰ和反应Ⅱ中,![]() 只作氧化剂的反应是________(填“Ⅰ”或“Ⅱ”);反应Ⅱ中,每生成标准状况下
只作氧化剂的反应是________(填“Ⅰ”或“Ⅱ”);反应Ⅱ中,每生成标准状况下![]() ,反应中转移________
,反应中转移________![]() 电子;
电子;![]() 和
和![]() 都能使澄清石灰水变浑浊,请设计一种方法检验
都能使澄清石灰水变浑浊,请设计一种方法检验![]() 、
、![]() 混合气体中的
混合气体中的![]() :_____________。
:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最活泼的金属元素、最活泼的非金属元素、常温下呈液态的金属(价电子排布为5d106s2)元素分别位于下面元素周期表中的( )
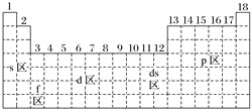
A. s区、p区、ds区 B. s区、p区、d区
C. f区、p区、ds区 D. s区、f区、ds区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅材料在工业生产中具有重要的应用,下列说法正确的是( )
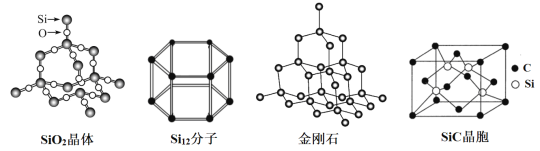
A.熔沸点比较:金刚石<SiC
B.SiC中Si原子的配位数为4
C.Si12与单晶硅互为同分异构体
D.1molSiO2中含有2molSi-O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题:
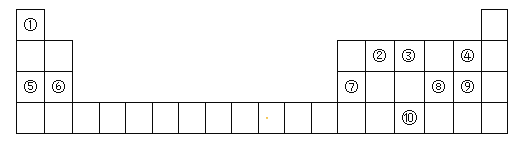
(1)元素⑩在周期表中的位置是_____,⑦的原子结构示意图为_____。
(2)④、⑤、⑥的简单离子半径由大到小的顺序为______(用离子符号和“>”表示)。
(3)④⑧⑨的气态氢化物中,最稳定的是______(用化学式表示),最高价氧化物对应水化物中,酸性最强的是_____(用化学式表示)。
(4)⑤的最高价氧化物对应的水化物与⑦的最高价氧化物对应的水化物发生反应的离子方程式___。
(5)由①③⑨组成的离子化合物的化学式为____,其中含有的化学键类型是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.将饱和FeCl3溶液滴入沸水中制备胶体:Fe3+ + 3H2O![]() Fe(OH)3↓ + 3H+
Fe(OH)3↓ + 3H+
B.NH4Cl溶于D2O中显酸性:NH4+ + D2O![]() NH3·HDO + D+
NH3·HDO + D+
C.AlCl3溶液与Na2S溶液混合生成沉淀:2Al3++3S2-=Al2S3↓
D.用FeS去除废水中的Hg2+:Hg2+ + S2-=HgS↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙三酸是一种有机酸,用H3A表示。25℃时,向1molL-1的H3A溶波中逐滴加入NaOH溶液,滴加过程中各种含A微粒物质的物质的量分数(δ)随溶液pH的变化曲线如图所示。下列相关说法错误的是( )
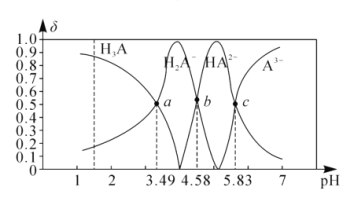
A.a点溶液中:c(H2A-)>c(Na+)>c(H+)>c(OH-)
B.25℃时,H3A的第二步电离平衡常数的数量级为10-5
C.b点溶液中:c(Na+)+c(H+)=3c(H2A-)+3c(A3-)+c(OH-)
D.当该溶液中c(HA2-)=c(A3-)时,溶液中水电离出的c(H+)>10-7molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com