
【题目】下列离子方程式正确的是
A.将饱和FeCl3溶液滴入沸水中制备胶体:Fe3+ + 3H2O![]() Fe(OH)3↓ + 3H+
Fe(OH)3↓ + 3H+
B.NH4Cl溶于D2O中显酸性:NH4+ + D2O![]() NH3·HDO + D+
NH3·HDO + D+
C.AlCl3溶液与Na2S溶液混合生成沉淀:2Al3++3S2-=Al2S3↓
D.用FeS去除废水中的Hg2+:Hg2+ + S2-=HgS↓
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是
A.气态氢化物的稳定性:H2O>NH3
B.氢元素与其他元素可形成共价化合物或离子化合物
C.如图所示实验可证明元素的非金属性:Cl>C>Si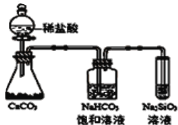
D.人工合成的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示物质间满足每一步转化均能实现的是( )
A.N2(g)![]() NO(g)
NO(g) ![]() NaNO2(aq)
NaNO2(aq)
B.NaCl(aq) ![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
C.![]()
D.Fe3O4(s) ![]() Fe(s)
Fe(s) ![]() Fe(NO3)3(aq)
Fe(NO3)3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列变化中:①I2升华,②烧碱熔化,③二氧化硅熔化,④NaCl溶于水,⑤![]() Cl溶于水,⑥晶体Ar熔化,⑦Na2O2溶于水,⑧
Cl溶于水,⑥晶体Ar熔化,⑦Na2O2溶于水,⑧![]() aHSO4溶于水。
aHSO4溶于水。
化学键未破坏的是___;只有共价键被破坏的是___;只有离子键被破坏的是___;共价键和离子键同时被破坏的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
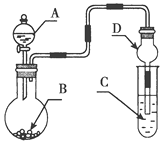
A.若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈红色
B.实验仪器D可以起到防止溶液倒吸的作用
C.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀后沉淀又溶解
D.若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Fe2+、I-、Br-的混合溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是( )
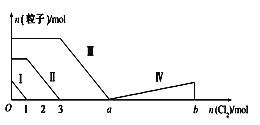
A.线段Ⅱ表示Br-的变化情况
B.原溶液中n(FeI2):n(FeBr2)=3:1
C.根据图像无法计算a的值
D.线段Ⅳ表示HIO3的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
(1)氨气的电子式为___,它的共价键属于___(填“极性”或“非极性”)键,其溶于水显碱性的理由是(用化学方程式表示)___。
(2)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且一定使平衡混合物中NH3的体积分数增大的是___。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(3)常温下,向100mL0.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。
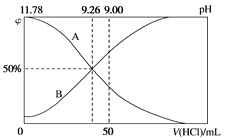
表示NH3·H2O浓度变化的曲线是___(填“A”或“B”)。
(4)当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O)=___mol/L(用数字表示)。若液氨中也存在类似水的电离(H2O+H2O![]() H3O++OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O++OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
①写出液氨的电离方程式:___。
②写出碳酸钠溶于液氨后第一级氨解的离子方程式:___。
③写出碳酸钠的液氨溶液中各离子浓度的大小关系:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I-具有还原性,含碘食盐中的碘元素主要以KIO3的形式存在,I-、I2、IO3-在一定条件下可发生如图转化关系。下列说法不正确的是
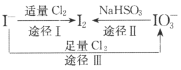
A.用淀粉-KI试纸和食醋可检验食盐是否加碘
B.由图可知氧化性的强弱顺序为C12>IO3->I2
C.生产等量的碘,途径I和途径Ⅱ转移电子数目之比为2:5
D.途径Ⅲ反应的离子方程式:3C12+I-+3H2O=6C1-+IO3-+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs 太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)基态亚铜离子(Cu+)的价电子排布图为_________;高温下CuO 容易转化为Cu2O,试从原子结构角度解释原因:_____。
(2)镓、砷、硒三种元素位于第四周期,其第一电离能从大到小的顺序为_____(用元素符号表示)
(3)GaCl3和AsF3的立体构型分别是_____,_____。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH) 4]-中B 原子的杂化类型为_____。②[B(OH)4 ]-的结构式为_____。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是_____(用化学式表示);②金刚石的晶胞参数为a pm(1pm=10-12 m)。1cm3晶体的平均质量为_____g(只要求列算式,阿伏加德罗常数为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com