
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs 太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)基态亚铜离子(Cu+)的价电子排布图为_________;高温下CuO 容易转化为Cu2O,试从原子结构角度解释原因:_____。
(2)镓、砷、硒三种元素位于第四周期,其第一电离能从大到小的顺序为_____(用元素符号表示)
(3)GaCl3和AsF3的立体构型分别是_____,_____。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH) 4]-中B 原子的杂化类型为_____。②[B(OH)4 ]-的结构式为_____。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是_____(用化学式表示);②金刚石的晶胞参数为a pm(1pm=10-12 m)。1cm3晶体的平均质量为_____g(只要求列算式,阿伏加德罗常数为NA)。
【答案】![]() Cu2O 中 Cu+的价层电子排布处于稳定的全充满状态 As>Se>Ga 平面三角形 三角锥型 sp3
Cu2O 中 Cu+的价层电子排布处于稳定的全充满状态 As>Se>Ga 平面三角形 三角锥型 sp3 ![]() C>SiC>Si
C>SiC>Si ![]()
【解析】
(1)基态铜 (Cu)的价电子排布式为3d104s1,其失去最外层1个电子后为亚铜离子(Cu+),排布式变为3d10,电子排布图为![]() ;亚铜离子(Cu+)价层电子排布处于全充满状态,较稳定,而铜离子价层电子排布为3d9,不稳定,故高温下CuO 容易转化为Cu2O;
;亚铜离子(Cu+)价层电子排布处于全充满状态,较稳定,而铜离子价层电子排布为3d9,不稳定,故高温下CuO 容易转化为Cu2O;
(2)镓、砷、硒三种元素分别位于第四周期IIIA族、VA族、VIA族,同周期从左到右元素的第一电离能呈增大趋势,但砷的4p能级处于半充满状态,As的第一电离能大于其相邻元素的第一电离能;
(3)用价层电子对互斥理论分析分子的构型;
(4)①[B(OH)4]-中的B原子上的孤电子对=![]() (a+1-bx)=
(a+1-bx)=![]() (3+1-4)=0,σ键电子对数为4,价层电子对数为4,则B 原子的杂化类型为sp3;
(3+1-4)=0,σ键电子对数为4,价层电子对数为4,则B 原子的杂化类型为sp3;
②其结构式为:![]() ;
;
(5)①金刚石、晶体硅、碳化硅均为原子晶体,共价键的键能与原子半径有关,原子半径越小共价键的键能越大,熔沸点越高,键能:C—C>C—Si>Si—Si,则熔点由高到低的排列顺序C>SiC>Si;
②金刚石的密度![]() =
=![]() 。
。
(1) 基态铜 (Cu)的价电子排布式为3d104s1,其失去最外层1个电子后为亚铜离子(Cu+),排布式变为3d10,电子排布图为![]() ;亚铜离子(Cu+)价层电子排布处于全充满状态,较稳定,而铜离子价层电子排布为3d9,不稳定,故高温下CuO 容易转化为Cu2O;则答案为Cu2O 中 Cu+的价层电子排布处于稳定的全充满状态;
;亚铜离子(Cu+)价层电子排布处于全充满状态,较稳定,而铜离子价层电子排布为3d9,不稳定,故高温下CuO 容易转化为Cu2O;则答案为Cu2O 中 Cu+的价层电子排布处于稳定的全充满状态;
(2)镓、砷、硒三种元素分别位于第四周期IIIA族、VA族、VIA族,同周期从左到右元素的第一电离能呈增大趋势,但砷的4p能级处于半充满状态,As的第一电离能大于其相邻元素的第一电离能,即第一电离能由大到小的顺序为As>Se>Ga;
(3)GaCl3中Ga上的孤电子对数为![]() ×(3-3×1)=0,σ键电子对数为3,价层电子对数为3,由于没有孤电子对,故其构型为平面三角形;AsF3中As上的孤电子对数为
×(3-3×1)=0,σ键电子对数为3,价层电子对数为3,由于没有孤电子对,故其构型为平面三角形;AsF3中As上的孤电子对数为![]() ×(5-3×1)=1,σ键电子对数为3,价层电子对数为4,由于含1对孤电子对,立体构型为三角锥型;;
×(5-3×1)=1,σ键电子对数为3,价层电子对数为4,由于含1对孤电子对,立体构型为三角锥型;;
(4)①[B(OH)4]-中的B原子上的孤电子对=![]() (a+1-bx)=
(a+1-bx)=![]() (3+1-4)=0,σ键电子对数为4,价层电子对数为4,则B 原子的杂化类型为sp3;
(3+1-4)=0,σ键电子对数为4,价层电子对数为4,则B 原子的杂化类型为sp3;
②其结构式为:![]() ;
;
(5)①金刚石、晶体硅、碳化硅均为原子晶体,共价键的键能与原子半径有关,原子半径越小共价键的键能越大,熔沸点越高,键能:C—C>C—Si>Si—Si,则熔点由高到低的排列顺序C>SiC>Si;
②金刚石的密度![]() =
=![]() ,1个金刚石晶胞中碳原子数=8
,1个金刚石晶胞中碳原子数=8![]() +6
+6![]() +4=8,体积V=a3 pm3=(a×10-10)3cm3,密度
+4=8,体积V=a3 pm3=(a×10-10)3cm3,密度![]() =
=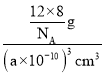 =
=![]() g/cm3,则1cm3晶体的平均质量为
g/cm3,则1cm3晶体的平均质量为![]() g。
g。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.将饱和FeCl3溶液滴入沸水中制备胶体:Fe3+ + 3H2O![]() Fe(OH)3↓ + 3H+
Fe(OH)3↓ + 3H+
B.NH4Cl溶于D2O中显酸性:NH4+ + D2O![]() NH3·HDO + D+
NH3·HDO + D+
C.AlCl3溶液与Na2S溶液混合生成沉淀:2Al3++3S2-=Al2S3↓
D.用FeS去除废水中的Hg2+:Hg2+ + S2-=HgS↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙三酸是一种有机酸,用H3A表示。25℃时,向1molL-1的H3A溶波中逐滴加入NaOH溶液,滴加过程中各种含A微粒物质的物质的量分数(δ)随溶液pH的变化曲线如图所示。下列相关说法错误的是( )
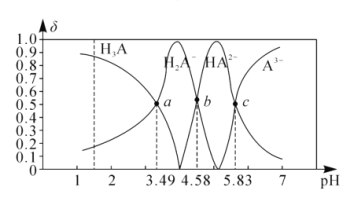
A.a点溶液中:c(H2A-)>c(Na+)>c(H+)>c(OH-)
B.25℃时,H3A的第二步电离平衡常数的数量级为10-5
C.b点溶液中:c(Na+)+c(H+)=3c(H2A-)+3c(A3-)+c(OH-)
D.当该溶液中c(HA2-)=c(A3-)时,溶液中水电离出的c(H+)>10-7molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
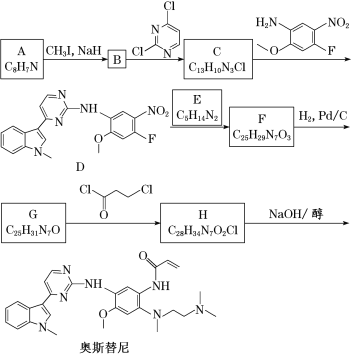
【题目】奥斯替尼用于治疗肺癌。某研究小组按下列路线合成奥斯替尼:
已知:R′-X(F、Cl、Br、I)+![]()
![]()
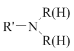 +HX(F、Cl、Br、I)
+HX(F、Cl、Br、I)
请回答:
(1)化合物E的结构简式:______。
(2)下列说法不正确的是________。
A 化合物A能发生加成反应 B 化合物D能与FeCl3溶液发生显色反应
C 化合物E具有碱性 D 奥斯替尼的分子式是C28H34N7O2
(3)写出B→C的化学方程式:______________。
(4)写出化合物E可能的同分异构体的结构简式:_______。
需同时符合:
①1HNMR谱表明分子中有3种氢原子;
②IR谱显示每个N原子都有N—H键存在。
(5)设计用甲烷、乙烯合成化合物![]() 的路线_______(用流程图表示,无机试剂任选)。
的路线_______(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O35H2O反应原理:Na2SO3(aq)+S(s)![]() Na2S2O3(aq)
Na2S2O3(aq)
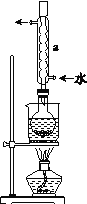
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O35H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)仪器a的名称是_________,其作用是__________________________。
(2)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是________。检验是否存在该杂质的方法是________________________________。
(3)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:________。
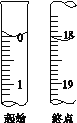
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 molL-1碘的标准溶液滴定。反应原理为2S2O32-+I2=S4O62-+2I-。
(4)滴定至终点时的判断依据是___________________________。
(5)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为_______mL。产品的纯度为(设Na2S2O35H2O相对分子质量为M)_________。(用含M的式子表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四硼酸钠的阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示。下列说法错误的是( )
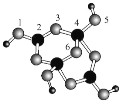
A.元素的第一电离能:O>H>B
B.在Xm-中,硼原子轨道的杂化类型有sp2和sp3
C.配位键存在于4、5原子之间和4、6原子之间
D.m=2,NamX的化学式为Na2B4O5(OH)4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(V)、 锰(Mn)、铁(Fe)、 砷(As)、硒(Se)均为第四周期的元素,完成下列问题。
(1)钒有+2、+3、+4、+5等几种化合价。这几种价态中,最稳定的是______。
(2)基态Fe2+的价层电子的轨道表示式为________,检验Fe3+可以用KSCN溶液,写出SCN-的一种等电子体分子_______。
(3)部分电离能数据如下:
Mn:![]() =717kJ/mol ,
=717kJ/mol ,![]() =1509kJ/mol ,
=1509kJ/mol ,![]() =3248kJ/mol ,
=3248kJ/mol ,
Fe:![]() =759kJ/mol,
=759kJ/mol,![]() =1562kJ/mol ,
=1562kJ/mol ,![]() =2957kJ/mol ,
=2957kJ/mol ,
根据数据可知,气态Mn2+ 再失去一个电子比气态Fe2+ 再失去一个电子难,其原因是____________________。
(4)沸点:NH3__________AsH3(填“>”、“<”或“=”),原因是_____________________。
(5)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3 酸性强的原因___________________________________ 。
(6)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:
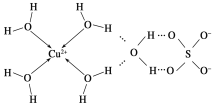
胆矾的化学式用配合物的形式表示为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香叶醇、橙花醇和乙酸橙花酯在工业上用作香料,它们可由月桂烯来合成。
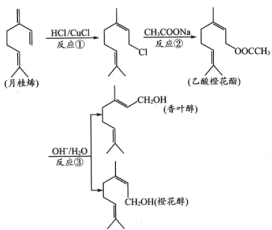
下列说法正确的是
A.反应①②③均为取代反应
B.月桂烯分子中所有碳原子全部处在同一平面上
C.香叶醇和橙花醇具有相同的分子式
D.乙酸橙花酯可以发生取代、加成、氧化和聚合反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com