
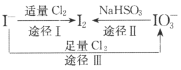
【题目】I-具有还原性,含碘食盐中的碘元素主要以KIO3的形式存在,I-、I2、IO3-在一定条件下可发生如图转化关系。下列说法不正确的是
A.用淀粉-KI试纸和食醋可检验食盐是否加碘
B.由图可知氧化性的强弱顺序为C12>IO3->I2
C.生产等量的碘,途径I和途径Ⅱ转移电子数目之比为2:5
D.途径Ⅲ反应的离子方程式:3C12+I-+3H2O=6C1-+IO3-+6H+
【答案】C
【解析】
A. 碘食盐中的碘元素主要以KIO3的形式存在,IO3-和I-在酸性条件下可生成I2,I2遇淀粉变蓝,A正确;
B. 由图途径Ⅲ可知,Cl2可将I-氧化为IO3-,氧化性Cl2>IO3-,途径Ⅱ可知IO3-可被还原为I2,氧化性为IO3->I2,则氧化性的强弱顺序为Cl2>IO3->I2,B正确;
C. 生产1mol碘,途径I中-1价碘转变为0价碘,需要转移2mol电子,途径Ⅱ中+5价碘转变为0价碘,需要转移10mol电子,故转移电子数目之比为1:5,C错误;
D. 途径Ⅲ中Cl2可将I-氧化为IO3-,而氯气被还原为Cl-,根据得失电子守恒和质量守恒,反应的离子方程式为:3Cl2+I-+3H2O=6Cl-+IO3-+6H+,D正确;
答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X与W同主族,Y原子的最外层电子数是其内层电子数的3倍,0.1 mol Z单质与足量盐酸反应产生H2的体积为3.36 L(折算成标准状况),W在元素周期表中的主族序数比其周期数大1。下列说法正确的是( )
A.XY2属于离子化合物
B.X的一种单质在高温下与WY2反应可制得W单质
C.原子半径:r(Z)>r(W)>r(Y)>r(X)
D.W的简单气态氢化物的热稳定性比Y的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业含铜废料含有 Cu、CuO、CuS、CuSO4 等成分,利用该含铜废料可生产硝酸铜晶体[Cu(NO3)2·3H2O],生产的工艺流程如图所示,请回答下列问题:

(1)“焙烧”过程中生成的废气中有害气体的成分是______________。
(2)“酸化”过程为加快反应速率,可采用的措施有___________________________(写出一条即可)。
(3)若试剂 a 可以是____________,试剂b的作用是______________________________________。
(4)“反应”一步中使用 20% HNO3 和 10% H2O2,整个过程无红棕色气体产生,则发生反应的离子方程式为______________________________________;若该步骤只使用 20% HNO3,随着反应的进行,温度升高,出现大量红棕色气体,则还原剂与氧化剂的物质的量之比为_______________。
(5)“系列操作”中应包含____________、______________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染物主要成分是SO2、NO2、NO、CO及可吸入颗粒等,主要来自于燃煤、机动车尾气和工业废气,会导致雾霾、酸雨等。
(1)汽车的三元催化转化器中,在催化剂作用下NO和CO转化为无毒气体,反应的化学方程式是: 2CO+2NO ![]() 2CO2+N2,该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式),当生成2mol N2时,转移电子的物质的量是____________________。
2CO2+N2,该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式),当生成2mol N2时,转移电子的物质的量是____________________。
(2)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2转化为SO42―。已知0.1mol/L 100mLNaClO溶液,可以恰好吸收0.01moL SO2,则反应的离子方程式是______________________。
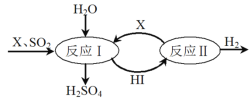
(3)SO2通过如图过程既能制得H2SO4又能制得H2。图中可循环利用的物质X是_________(填化学式),制得H2SO4的化学方程式是__________________________。
(4)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:NO2+NO+2NaOH===2NaNO2+H2O 2NO2+2NaOH===NaNO2+NaNO3+H2O
现有V L某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。所用烧碱溶液的物质的量浓度至少为________ mol·L1。若所得溶液中c(![]() )∶c(
)∶c(![]() )=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=____________________。
)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO42﹣、Cl﹣
B.![]() =1×10﹣15mol/L的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
=1×10﹣15mol/L的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3﹣、SO42﹣
D.水电离的c(H+)=1×10﹣15mol/L的溶液中:K+、Na+、AlO2﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.0g铜与60.0mL一定浓度的硝酸发生如下反应:Cu+4HNO3 = Cu(NO3)2+2NO2↑+2H2O;3Cu+8HNO3 = 3Cu(NO3)2+2NO↑+4H2O。铜完全溶解产生的混合气体体积为8.96L(标况)。请计算(各数据保留两位有效数字):
(1)NO的体积为______
(2)该混合气体的平均摩尔质量约为______
(3)待产生的气体全部释放后,向溶液加入100mL 2.0mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.6 g镁铝合金,投入到500 mL 2 mol/L的盐酸中,合金完全溶解,再加入4 mol/L的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是( )
A.150 mLB.200 mLC.250 mLD.280 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组将纯净的SO2气体缓缓的通入到盛有25mL0.1mol· L-1的Ba(NO3)2溶液中,得到BaSO4沉淀。为探究该反应中的氧化剂,该小组提出了如下假设:
假设Ⅰ:溶液中的NO3-;
假设Ⅱ:________________。
(1)该小组设计了以下实验验证了假设Ⅰ成立(为排除假设Ⅱ对假设Ⅰ的干扰,在配制下列实验所用溶液时,应___________________),请填写下表。
实验步骤 | 实验现象 | 结论 | |
实验① | 向盛有25mL0.1mol·L-1BaCl2溶液的烧杯中缓慢通入纯净的SO2气体 | ______ | 假设Ⅰ成立 |
实验② | 向盛有25mL0.1mol· L-1Ba(NO3)2溶液的烧杯中缓慢通入纯净的SO2气体 | ______ | |
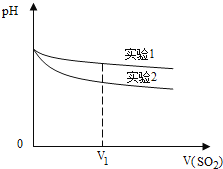
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图。V1时,实验②中溶液pH小于实验①的原因是(用离子方程式表示):________。
(3)验证假设Ⅱ。某同学设计了以下方案,请完成下列表格(可以不填满)。
实验步骤 | 实验现象 | 实验目的 | ||
实验③ | 同实验①步骤 | 同实验①的相关现象 | ______ | |
实验④ | ______ | ______ | ______ | |
(4)查资料知:H2SO3是二元酸(Kl=1.54×10-2,K2=1.02×10-7),请设计实验方案验证H2SO3是二元酸______(试剂及仪器自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H =-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H =+116.49 kJ·mol-1
③H2O(l)=H2O(g)△H =+88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式______________。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH<0
CH4(g)+2H2O(g) ΔH<0
①向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为_____、_____,CO2的平衡转化率为______。
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器I、II,在I中充入1 molCO2,和4 molH2,在II中充入1 mol CH4和2 mol H2 O(g),300℃下开始反应。达到平衡时,下列说法正确的是_________(填字母)。
A.容器I、II中正反应速率相同 B.容器I、II中CH4的物质的量分数相同 C.容器I中CO2的物质的量比容器II中的多 D.容器I中CO2的转化率与容器II中CH4的转化率之和小于1
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
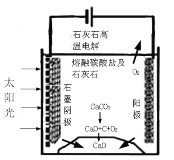
①上述生产过程的能量转化方式是_____。
②上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为___,阴极的电极反应式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com