
ЁОЬтФПЁПНЋ32.0gЭгы60.0mLвЛЖЈХЈЖШЕФЯѕЫсЗЂЩњШчЯТЗДгІЃКCuЃЋ4HNO3 = Cu(NO3)2ЃЋ2NO2ЁќЃЋ2H2OЃЛ3CuЃЋ8HNO3 = 3Cu(NO3)2ЃЋ2NOЁќЃЋ4H2OЁЃЭЭъШЋШмНтВњЩњЕФЛьКЯЦјЬхЬхЛ§ЮЊ8.96L(БъПі)ЁЃЧыМЦЫу(ИїЪ§ОнБЃСєСНЮЛгааЇЪ§зж)ЃК
(1)NOЕФЬхЛ§ЮЊ______
(2)ИУЛьКЯЦјЬхЕФЦНОљФІЖћжЪСПдМЮЊ______
(3)Д§ВњЩњЕФЦјЬхШЋВПЪЭЗХКѓЃЌЯђШмвКМгШы100mL 2.0mol/LЕФNaOHШмвКЃЌЧЁКУЪЙШмвКжаЕФCu2+ШЋВПзЊЛЏГЩГСЕэЃЌдђдЯѕЫсШмвКЕФХЈЖШЮЊ______ЁЃ
ЁОД№АИЁП6.7L 34 g/mol 10mol/L
ЁОНтЮіЁП
(1)n(Cu)=![]() =0.5molЃЌn(NO+NO2)=
=0.5molЃЌn(NO+NO2)=![]() =0.4molЁЃ
=0.4molЁЃ
ЩшNOЕФЮяжЪЕФСПЮЊxЃЌдђNO2ЕФЮяжЪЕФСПЮЊ0.4-x;
вРОнЕчзгЪиКуЃЌПЩЕУГіШчЯТЙиЯЕЪНЃК3x+(0.4-x)ЁС1=0.5molЁС2ЃЌЧѓГіxКѓЃЌМДПЩЧѓГіNOЕФЬхЛ§ЁЃ
(2)ЧѓГіNOЁЂNO2ЕФЮяжЪЕФСПЃЌдйРћгУM=![]() МДПЩЧѓГіИУЛьКЯЦјЬхЕФЦНОљФІЖћжЪСПЁЃ
МДПЩЧѓГіИУЛьКЯЦјЬхЕФЦНОљФІЖћжЪСПЁЃ
(3)Д§ВњЩњЕФЦјЬхШЋВПЪЭЗХКѓЃЌЯђШмвКМгШы100mL 2.0mol/LЕФNaOHШмвКЃЌЧЁКУЪЙШмвКжаЕФCu2+ШЋВПзЊЛЏГЩГСЕэЃЌДЫЪБШмжЪЮЊNaNO3ЁЃДгЖјЕУГіБэЯжГіЫсадЕФЯѕЫсКЭЪЃгрЕФЯѕЫсЕФЮяжЪЕФСПЃЌдйМгЩЯБэЯжГіЧПбѕЛЏадЕФЯѕЫсЕФЮяжЪЕФСПЃЌМДПЩЧѓГідЯѕЫсЕФЮяжЪЕФСПЃЌзюКѓЧѓГідЯѕЫсШмвКЕФХЈЖШЁЃ
(1)n(Cu)=![]() =0.5molЃЌn(NO+NO2)=
=0.5molЃЌn(NO+NO2)=![]() =0.4molЁЃ
=0.4molЁЃ
ЩшNOЕФЮяжЪЕФСПЮЊxЃЌдђNO2ЕФЮяжЪЕФСПЮЊ0.4-x;
вРОнЕчзгЪиКуЃЌПЩЕУГіШчЯТЙиЯЕЪНЃК3x+(0.4-x)ЁС1=0.5molЁС2ЃЌx=0.3molЃЌ
V(NO)=0.3molЁС22.4L/mol=6.7LЁЃД№АИЮЊЃК6.7LЃЛ
(2)n(NO)=0.3molЃЌдђn(NO2)=0.1molЃЌM=![]() =34ЁЃД№АИЮЊЃК34 g/molЃЛ
=34ЁЃД№АИЮЊЃК34 g/molЃЛ
(3)n(Ысад)+n(гр)=n(NaOH)= 0.100mLЁС2.0mol/L=0.2molЃЌn(бѕЛЏад)=0.4molЃЌ
n(зм)=0.2mol+0.4mol=0.6molЃЌc(HNO3)=![]() =10mol/LЁЃД№АИЮЊЃК10mol/LЁЃ
=10mol/LЁЃД№АИЮЊЃК10mol/LЁЃ


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдк25ЁцЪБЃЌУмБеШнЦїжаXЁЂYЁЂZШ§жжЦјЬхЕФГѕЪМХЈЖШКЭЦНКтХЈЖШШчЯТБэЃК
ЮяжЪ | X | Y | Z |
ГѕЪМХЈЖШ/molЁЄL-1 | 0.1 | 0.2 | 0 |
ЦНКтХЈЖШ/molЁЄL-1 | 0.05 | 0.05 | 0.1 |
ЯТСаЫЕЗЈДэЮѓЕФЪЧ
A.ЗДгІДяЕНЦНКтЪБЃЌXЕФзЊЛЏТЪЮЊ50ЃЅ
B.діДѓбЙЧПЪЙЦНКтЯђЩњГЩZЕФЗНЯђвЦЖЏ
C.дк25ЁцЯТЃЌЗДгІЕФЦНКтГЃЪ§ЮЊ1600ЃЌИФБфЮТЖШПЩвдИФБфДЫЗДгІЕФЦНКтГЃЪ§
D.дк25ЁцЯТЃЌВтЕУc(X)=0.04molЁЄL-1ЃЌc(Y)=0.1molЁЄL-1ЃЌc(Z)=0.08molЁЄL-1ЃЌдђДЫЪБvе§<vФц
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЯђ 100 mL еєСѓЫЎжаЕЮШы10 mL 5 molЁЄLЃ1HAШмвКЃЌРћгУДЋИаЦїВтЕУШмвКжа c (HЃЋ)КЭЮТЖШЫцзХМгШы HA ШмвКЬхЛ§ЕФБфЛЏЧњЯпШчЭМЫљЪОЃЌЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ
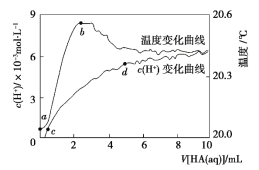
A.HA ЪЧЧПЫс
B.a ЁЋ b ЖЮЃЌHA ЕчРыЗХШШЃЌЪЙШмвКЮТЖШЩ§Ип
C.c ЁЋ d ЖЮЃЌ c (HЃЋ)діДѓЃЌHA ЕчРыГЬЖШдіДѓ
D.c ЕуЪБЃЌМгШыЕШЬхЛ§ЕШХЈЖШЕФ NaOH ШмвКЃЌдђ c (NaЃЋ)ЃН c (AЃ)ЃЋ c (HA)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЮТЖШКЭбЙЧПЯТЃЌНЋЕШжЪСПЕФCH4ЁЂCO2ЁЂO2ЁЂSO2ЫФжжЦјЬхЗжБ№ДЕШыЫФИіВЛЭЌЕФЦјЧђЃЌЯТСаЫЕЗЈжае§ШЗЕФЪЧ( )

A.ЦјЧђЂкжазАЕФЪЧO2
B.ЦјЧђЂйКЭЦјЧђЂлжаЦјЬхЗжзгЪ§ЯрЕШ
C.ЦјЧђЂйКЭЦјЧђЂмжаЦјЬхЮяжЪЕФСПжЎБШЮЊ4ЁУ1
D.ЦјЧђЂлКЭЦјЧђЂмжаЦјЬхУмЖШжЎБШЮЊ2ЁУ1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПIЃОпгаЛЙдадЃЌКЌЕтЪГбЮжаЕФЕтдЊЫижївЊвдKIO3ЕФаЮЪНДцдкЃЌIЃЁЂI2ЁЂIO3ЃдквЛЖЈЬѕМўЯТПЩЗЂЩњШчЭМзЊЛЏЙиЯЕЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
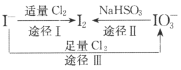
A.гУЕэЗлЃKIЪджНКЭЪГДзПЩМьбщЪГбЮЪЧЗёМгЕт
B.гЩЭМПЩжЊбѕЛЏадЕФЧПШѕЫГађЮЊC12ЃОIO3ЃЃОI2
C.ЩњВњЕШСПЕФЕтЃЌЭООЖIКЭЭООЖЂђзЊвЦЕчзгЪ§ФПжЎБШЮЊ2ЃК5
D.ЭООЖЂѓЗДгІЕФРызгЗНГЬЪНЃК3C12+IЃ+3H2O=6C1Ѓ+IO3Ѓ+6H+
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПCO2ЕФЙЬЖЈКЭзЊЛЏЪЧЪРНчадПЮЬтЁЃРМжнДѓбЇОАЛЖЭњНЬЪкЭХЖгЧЩУюЩшМЦЙЙНЈСЫЯЕСааТаЭЙтЕчДпЛЏШЫЙЄЙтКЯГЩЬхЯЕЁЊЁЊЙтЕчДпЛЏГиЃЌp-nАыЕМЬхвьжЪНсДпЛЏCO2дкЫЎжажБНгжЦБИГЄЬМСДгаЛњЮяВЂЗХГібѕЦјЃЌдРэШчЭМЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ

A.ЕчМЋ1ЕФЕчЪЦБШЕчМЋ2ЕФЕчЪЦИп
B.ИУЩшМЦЯђДѓздШЛбЇЯАЃЌФЃЗТжВЮяЕФЙтКЯзїгУ
C.ЕчзгДгaМЋСїЕНЕчМЋ1ЃЌДгЕчМЋ2СїЕНbМЋ
D.ИКМЋЧјЃЌp-nЮЊДпЛЏМСЃЌCO2ЗЂЩњЛЙдЗДгІЩњГЩГЄЬМСДгаЛњЮя
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШ§ВнЫсКЯЬњЫсМиОЇЬхЃЈK3[FeЃЈC2O4ЃЉ3]xH2OЃЉЃЈЦфжаЬњЕФЛЏКЯМлЮЊ+3МлЃЉЪЧвЛжжЙтУєВФСЯЃЌдк110ЁцПЩЭъШЋЪЇШЅНсОЇЫЎЁЃЮЊВтЖЈИУОЇЬхжаЬњЕФКЌСПКЭНсОЇЫЎЕФКЌСПЃЌФГЪЕбщаЁзщзіСЫШчЯТЪЕбщЃК
ЂёЃЎЬњКЌСПЕФВтЖЈ
ВНжш1ЃКГЦСП5.00gШ§ВнЫсКЯЬњЫсМиОЇЬхЃЌХфжЦГЩ250mLШмвКЁЃ
ВНжш2ЃКШЁШмвК25..00mLгкзЖаЮЦПжаЃЌЫсЛЏЃЌЕЮМгKMnO4ШмвКжСВнЫсИљЃЈC2O42ЉЃЉЧЁКУШЋВПБЛбѕЛЏГЩCO2ЃЌЭЌЪБЃЌMnO4ЉБЛЛЙдГЩMn2+ЃЛЯђЗДгІКѓЕФШмвКжаМгШыаПЗлжСЛЦЩЋИеКУЯћЪЇЃЌЙ§ТЫЃЌЯДЕгЃЌНЋЙ§ТЫМАЯДЕгЫљЕУШмвКЪеМЏЕНзЖаЮЦПжаЃЌДЫЪБЃЌШмвКШдГЪЫсадЁЃ
ВНжш3ЃКгУ0.010mol/LKMnO4ШмвКЕЮЖЈВНжш2ЫљЕУШмвКжСжеЕуЃЌЯћКФKMnO4ШмвК20.02mLЃЌЕЮЖЈжаMnO4ЉБЛЛЙдГЩMn2+ЁЃ
жиИДВНжш2ЁЂВНжш3ВйзїЃЌЕЮЖЈЯћКФ0.010mol/LKMnO4ШмвК19.98mLЁЃ
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉВНжш2жаМгШыаПЗлжСЛЦЩЋИеКУЯћЪЇЃЌФПЕФЪЧ_____ЁЃ
ЃЈ2ЃЉаДГіВНжш3жаЗЂЩњЗДгІЕФРызгЗНГЬЪН_____ЁЃ
ЃЈ3ЃЉИљОнЪЕбщЪ§ОнЃЌВтЕУИУОЇЬхжаЬњдЊЫиЕФжЪСПЗжЪ§ЮЊ_____ЁЃ
ЃЈ4ЃЉШєВНжш2жаМгШыЕФKMnO4ШмвКЕФСПВЛзуЃЌдђВтЕУЕФЬњКЌСП_____ЃЈбЁЬюЁАЦЋЕЭЁБЁАЦЋИпЁБЛђЁАВЛБфЁБЃЉ
ЂђЃЎНсОЇЫЎЕФВтЖЈ
ЃЈ5ЃЉВЩгУШШжиЗжЮівЧВтЖЈШ§ВнЫсКЯЬњЫсМиОЇЬхK3[FeЃЈC2O4ЃЉ3]xH2Oдк110ЁцЪБЕФЪЇжиТЪЮЊa%ЃЌдђОЇЬх
ЛЏбЇЪНжаНсОЇЫЎИіЪ§xЕФМЦЫуЪНЮЊ_____ЁЃЃЈгУКЌaЕФДњЪ§ЪНБэЪОЃЉЃЈвбжЊЃКШ§ВнЫсКЯЬњЫсМиЕФФІЖћжЪСПMЃЈK3[FeЃЈC2O4ЃЉ3]ЃЉЃН437g/molЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25ЁцЪБЃЌдк20mL0.1molLЉ1NaOHШмвКжаж№ЕЮМгШы0.2molLЉ1ЕФФГвЛдЊШѕЫсHXШмвКЃЌЧњЯпШчЭМЫљЪОЃЌгаЙиСЃзгХЈЖШЙиЯЕЕФБШНЯжаЃЌДэЮѓЕФЪЧЃЈЁЁЁЁЃЉ

A.дкAЕуЃКcЃЈNa+ЃЉЃОcЃЈOHЉЃЉЃОcЃЈXЉЃЉЃОcЃЈH+ЃЉ
B.дкBЕуЃКcЃЈOHЉЃЉЃНcЃЈH+ЃЉЃНcЃЈNa+ЃЉЃНcЃЈXЉЃЉ
C.дкCЕуЃКcЃЈXЉЃЉЃОcЃЈNa+ЃЉЃОcЃЈH+ЃЉЃОcЃЈOHЉЃЉ
D.дкCЕуЃКcЃЈXЉЃЉ+cЃЈHXЃЉЃН2cЃЈNa+ЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖўбѕЛЏТШ(ClO2)ЪЧвЛжжЙуЦзЁЂИпаЇЕФЩБОњЯћЖОМСЃЌгагыТШЦјЯрЫЦЕФЧПСвДЬМЄадЦјЮЖЃЌвзШмгкЫЎЃЌЗаЕу11ЁцЃЌгіШШВЛЮШЖЈвзЗжНтЗЂЩњБЌеЈЁЃвЛжжЙЄвЕжЦЗЈгУСђЬњПѓ(жївЊГЩЗжЮЊFeS2)ЛЙдТШЫсФЦжЦШЁЖўбѕЛЏТШЃЌФГбаОПаЁзщдкЪЕбщЪвЩшМЦШчЯТзАжУжЦБИClO2ЕФЫЎШмвКЁЃ
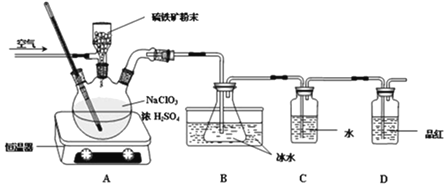
(1)Ш§ОБЩеЦПжаМгШыNaClO3ШмвКЁЂХЈH2SO4ЃЌЭЈШыПеЦјЃЌЕїНкКуЮТЦїжС60ЁцЃЌЭЈЙ§ЙЬЬхМгСЯЦїЛКТ§дШЫйМгШыСђЬњПѓЗлФЉЁЃЗДгІПЊЪМЪБЩеЦПФкЗЂЩњЗДгІЕФРызгЗНГЬЪНШчЯТЃЌЧыХфЦНИУЗНГЬЪНЃК__ClO3Ѓ ЃЋ__FeS2ЃЋ__HЃЋЃН____ClO2ЃЋ____Fe3ЃЋЃЋ____SO42ЃЃЋ____H2O
(2)зАжУDЕФзїгУЪЧ__________ЁЃ
(3)гУЩЯЪіЗДгІЭъКѓЕФЗЯвК(Г§ЩЯЪіВњЮяЭтЃЌЛЙгаAl3ЃЋЁЂMg2ЃЋЁЂHЃЋЁЂClЃЕШ)ПЩжЦБИФІЖћбЮЃЌМД(NH4)2Fe(SO4)2ЁЄ6H2OЁЃЦфВйзїСїГЬШчЯТЃК

ЛиД№ЯТСаЮЪЬтЃК
ЂйВйзїЂёЕФУћГЦЮЊЃК___________ЁЃ
ЂкЪдМСXЪЧ___________ЃЌаДГіЗЂЩњЕФжївЊЗДгІЕФРызгЗНГЬЪН__________ЁЃ
ЂлЮЊВтЖЈ(NH4)2Fe(SO4)2ЁЄ6H2OОЇЬхжаЬњЕФКЌСПЃЌФГЪЕбщаЁзщзіСЫШчЯТЪЕбщЃКгУЕчзгЬьЦНзМШЗГЦСП5.000gСђЫсбЧЬњяЇОЇЬхЃЌХфжЦГЩ250mLШмвКЁЃШЁЫљХфШмвК25.00mLгкзЖаЮЦПжаЃЌМгЯЁH2SO4ЫсЛЏЃЌгУ0.01000mol/L KMnO4ШмвКЕЮЖЈжСFe2+ЧЁКУШЋВПбѕЛЏГЩFe3+ЃЌЭЌЪБЃЌMnO4ЃпБЛЛЙдГЩMn2+ЁЃВтЕУЯћКФKMnO4ШмвКЕФЦНОљЬхЛ§ЮЊ21.00mLЁЃдђИУОЇЬхжаЬњЕФжЪСПЗжЪ§ЮЊ___________ЁЃ(БЃСє4ЮЛгааЇЪ§зж)
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com