
【题目】向含Fe2+、I-、Br-的混合溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是( )
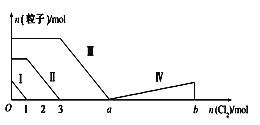
A.线段Ⅱ表示Br-的变化情况
B.原溶液中n(FeI2):n(FeBr2)=3:1
C.根据图像无法计算a的值
D.线段Ⅳ表示HIO3的变化情况
【答案】D
【解析】
向仅含Fe2+、I-、Br-的溶液中通入适量氯气,还原性I->Fe2+>Br-,首先发生反应2I-+Cl2=I2+2Cl-,I-反应完毕,再反应反应2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕,最后发生反应2Br-+Cl2=Br2+2Cl-,故线段I代表I-的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br-的变化情况;通入氯气,根据反应离子方程式可知溶液中n(I-)=2n(Cl2)=2mol,溶液中n(Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,Fe2+反应完毕,根据电荷守恒可知n(I-)+n(Br-)=2n(Fe2+),故n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,据此分析解答。
A.根据分析可知,线段Ⅱ为亚铁离子被氯气氧化为铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,不是氧化溴离子,故A错误;
B.n(FeI2):n(FeBr2)=n(I-):n(Br-)=2mol:6mol=1:3,故B错误;
C.由分析可知,溶液中n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,根据2Br-+Cl2=Br2+2Cl-可知,溴离子反应需要氯气的物质的量为3mol,故a=3+3=6,故C错误;
D.线段IV表示一种含氧酸,且I和IV表示的物质中含有相同的元素,该元素为I元素,已知碘单质的物质的量为1mol,反应消耗氯气的物质的量为5mol,根据电子守恒,则该含氧酸中碘元素的化合价为:![]() ,则该含氧酸为HIO3,即:线段Ⅳ表示HIO3的变化情况,故D正确;
,则该含氧酸为HIO3,即:线段Ⅳ表示HIO3的变化情况,故D正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】下列说法中不正确的有( )个
①反应速率用于衡量化学反应进行的快慢
②可逆反应达到化学平衡状态时,正、逆反应速率都为0
③决定反应速率的主要因素是反应物的性质
④适当增大反应物浓度,提高反应温度都能增大反应速率
⑤不管什么反应使用催化剂,都可以加快反应速率 ,并可以使平衡移动。
⑥可逆反应A(g)![]() B(g)+C(g),增大压强,正反应速率减小,逆反应速率增大
B(g)+C(g),增大压强,正反应速率减小,逆反应速率增大
⑦对达到平衡的一个放热的可逆反应,若降温,则正反应速率减小,逆反应速率增大
A. 2 个 B. 3 个 C. 4 个 D. 5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅材料在工业生产中具有重要的应用,下列说法正确的是( )
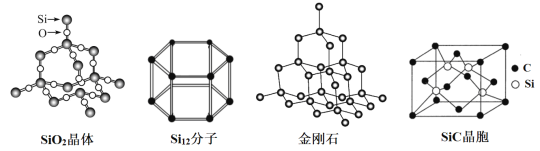
A.熔沸点比较:金刚石<SiC
B.SiC中Si原子的配位数为4
C.Si12与单晶硅互为同分异构体
D.1molSiO2中含有2molSi-O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是
A. 实验室用固体氯化铵和熟石灰共热制取NH3:2NH4++Ca(OH)2![]() 2NH3↑+ Ca2++2H2O
2NH3↑+ Ca2++2H2O
B. 铜与浓硝酸反应: 3Cu + 8H+ + 2NO3-=3Cu2+ + 2NO↑ + 4H2O
C. 氨水与FeCl3溶液反应:3OH-+ Fe3+ =Fe(OH)3↓
D. Na2O2投入水中:2Na2O2+2H2O = 4Na++4OH-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.将饱和FeCl3溶液滴入沸水中制备胶体:Fe3+ + 3H2O![]() Fe(OH)3↓ + 3H+
Fe(OH)3↓ + 3H+
B.NH4Cl溶于D2O中显酸性:NH4+ + D2O![]() NH3·HDO + D+
NH3·HDO + D+
C.AlCl3溶液与Na2S溶液混合生成沉淀:2Al3++3S2-=Al2S3↓
D.用FeS去除废水中的Hg2+:Hg2+ + S2-=HgS↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入到含1 mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确; Cl2过量,Fe2+、I-均被氧化 |
B | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++2HCO | 正确;Mg(OH)2比MgCO3更难溶 |
C | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-=HClO+HSO | 正确;H2SO3的酸性强于HClO |
D | 将Na2O2固体溶于水:2Na2O2+2H2O=4Na++4OH-+O2↑ | 正确; Na2O2是碱性氧化物 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据最高能层的符号是________,占据该能层电子的电子云轮廓图形状为________________。
(3)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能(kJ/mol) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是________价,其基态原子电子排布式为____________
(4)PO43-的中心原子的杂化方式为__________,键角为_______________
(5)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为________________
(6)下列元素或化合物的性质变化顺序正确的是__________________
A.第一电离能:Cl>S>P>Si B.共价键的极性:HF>HCI>HBr>HI
C.晶格能:NaF>NaCl>NaBr>NaI D.热稳定性:MgCO3>CaCO3>SrCO3>BaCO3
(7)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_____________;已知Ca2+和F-半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为___________________g·cm-3(不必化简)。
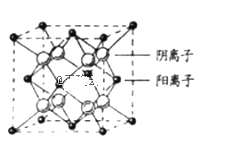
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四硼酸钠的阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示。下列说法错误的是( )
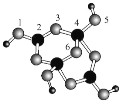
A.元素的第一电离能:O>H>B
B.在Xm-中,硼原子轨道的杂化类型有sp2和sp3
C.配位键存在于4、5原子之间和4、6原子之间
D.m=2,NamX的化学式为Na2B4O5(OH)4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com