
����Ŀ�������������ʵ���Ҫ���������ʽṹ����ش��������⣺
(1)Ԫ��K����ɫ��Ӧ���Ϻ�ɫ��������ɫ��Ӧ�ķ��䲨��Ϊ_______nm(����)��
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)��̬Kԭ���У��������ռ������ܲ�ķ�����________��ռ�ݸ��ܲ���ӵĵ���������ͼ��״Ϊ________________��
(3)��֪Ԫ��M���������Ca5(PO4)3F��һ��Ԫ�ء�Ԫ��M����̬ԭ�����ʧȥ��1������5��������������(�������ܣ��÷���I1��I5��ʾ)�����ʾ��
I1 | I2 | I3 | I4 | I5 | |
������(kJ/mol) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
Ԫ��M����̬�������ϼ���________�ۣ����̬ԭ�ӵ����Ų�ʽΪ____________
(4)PO43��������ԭ�ӵ��ӻ���ʽΪ__________������Ϊ_______________
(5)Ca3(PO4)3F�зǽ���Ԫ�ص縺���ɴ�С��˳��Ϊ________________
(6)����Ԫ�ػ�������ʱ仯˳����ȷ����__________________
A.��һ�����ܣ�Cl��S��P��Si B.���ۼ��ļ��ԣ�HF��HCI��HBr��HI
C.�����ܣ�NaF��NaCl��NaBr��NaI D.���ȶ��ԣ�MgCO3��CaCO3��SrCO3��BaCO3
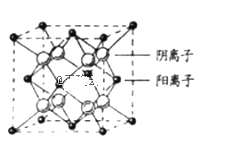
(7)CaF2�����ṹ��ͼ��ʾ����CaF2��������Ca2+����ҵȾ����Ca2+��ĿΪ_____________����֪Ca2+��F���뾶�ֱ�Ϊa cm��b cm�������ӵ�����ΪNA��MΪĦ�������������ܶ�Ϊ___________________g��cm��3(���ػ���)��
���𰸡�A N ���� +2 1s22s22p63s23p64s2��[Ar] 4s2 sp3 109��28�� F>O>P BC 12 
��������
(1)��ɫ��������400nm~430nm��
(2) ��̬Kԭ�ӹ���4�����Ӳ㣬����ܲ�λN���۲�����Ų�ʽΪ4s1��
(3) M�ĵ���������ԶԶ���ڵڶ������ܣ���Ԫ���������2�����ӣ�
(4) ���ݼ۲���ӻ�������ȷ��PO43-�ӻ���ʽ���ռ乹�ͣ�
(5)Ca3(PO4)3F�зǽ���Ԫ��ΪP��O��F��ͬ��������Ԫ��������ҵ縺������ͬ�������϶��µ縺�Լ�С��
(6) A.ͬ����Ԫ�صĵ�һ����������������ƣ��۲���Ӵ��ڳ���������״̬ʱ����һ�����ܴ������Ԫ�صģ�
B. ����ԭ�ӵĵ������ܻ�縺�ԵIJ�ֵԽ����Խ��
C.���Ӱ뾶ԽС������Խ�̣�������Խ��
D.���������ӵİ뾶ԽС����̼���ε����ȶ���Խ����
(7)CaF2�����У��붥��Ca2+����ҵȾ����Ca2+���ھ������ģ�ÿ������Ϊ8���������ã�ÿ������Ϊ2���������ã�ÿ����������Χ��4�������ӣ��ĸ��������γ���������ṹ�������Ӵ��������������ģ�������������������������ķ��������ߴ��ھ����Խ����ϣ��Ҷ��߾�����ھ�����Խ��߳��ȵ�![]() ��
��
(1)��ɫ��������400nm~430nm����ΪA��
(2) ��̬Kԭ�ӹ���4�����Ӳ㣬����ܲ�λN���۲�����Ų�ʽΪ4s1�����ܲ����������Ϊ���Σ�
(3) M�ĵ���������ԶԶ���ڵڶ������ܣ�˵����Ԫ��ʧȥ2������ʱΪ�ȶ��ṹ�����Ԫ���������2�����ӣ���MΪCa��Ԫ��M����̬�������ϼ���+2�����̬ԭ�ӵ����Ų�ʽΪ1s22s22p63s23p64s2��[Ar] 4s2��
(4) PO43-������ԭ��P�ŵ��Ӷ���=![]() ��a-bx��=
��a-bx��=![]() (5+3-2��4)=0���۲���Ӷ���=4+0=4��Pԭ���ӻ���ʽΪsp3�ӻ������ռ乹��Ϊ�������壬����Ϊ109��28����
(5+3-2��4)=0���۲���Ӷ���=4+0=4��Pԭ���ӻ���ʽΪsp3�ӻ������ռ乹��Ϊ�������壬����Ϊ109��28����
(5)Ca3(PO4)3F�зǽ���Ԫ��ΪP��O��F��ͬ��������Ԫ��������ҵ縺������ͬ�������϶��µ縺�Լ�С���ʵ縺�ԣ�F>O>P��
(6) A.ͬ����Ԫ�صĵ�һ����������������ƣ��۲���Ӵ��ڳ���������״̬ʱ����һ�����ܴ������Ԫ�صģ���Cl��P��S��Si��A����
B. ����ԭ�ӵĵ������ܻ�縺�ԵIJ�ֵԽ����Խ���ۼ��ļ��ԣ�HF��HCl��HBr��HI��B��ȷ��
C.���Ӱ뾶ԽС������Խ�̣�������Խ�����ܣ�NaF��NaCl��NaBr��NaI��C��ȷ��
D.���������ӵİ뾶ԽС����̼���ε����ȶ���Խ���������ȶ��ԣ�BaCO3��SrCO3��CaCO3��MgCO3��D����
��ΪBC��
(7)CaF2�����У��붥��Ca2+����ҵȾ����Ca2+���ھ������ģ�ÿ������Ϊ8���������ã�ÿ������Ϊ2���������ã���CaF2��������Ca2+����ҵȾ����Ca2+��ĿΪ��![]() =12��ÿ����������Χ��4�������ӣ��ĸ��������γ���������ṹ�������Ӵ��������������ģ�������������������������ķ��������ߴ��ھ����Խ����ϣ��Ҷ��߾�����ھ�����Խ��߳��ȵ�
=12��ÿ����������Χ��4�������ӣ��ĸ��������γ���������ṹ�������Ӵ��������������ģ�������������������������ķ��������ߴ��ھ����Խ����ϣ��Ҷ��߾�����ھ�����Խ��߳��ȵ�![]() ��Ca2+��F-�뾶�ֱ�Ϊa cm��b cm������Խ��߳���Ϊ4��a+b��cm���ʾ����ⳤ=
��Ca2+��F-�뾶�ֱ�Ϊa cm��b cm������Խ��߳���Ϊ4��a+b��cm���ʾ����ⳤ=![]() (a+b)cm��������Ca2+��Ŀ=8��
(a+b)cm��������Ca2+��Ŀ=8��![]() +6��
+6��![]() =4��F-��ĿΪ8���ʾ�������=4��Mg�������ܶ�=
=4��F-��ĿΪ8���ʾ�������=4��Mg�������ܶ�= gcm-3��
gcm-3��


 53������ϵ�д�
53������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʯ�ͷ�������ʾ��ͼ��a��b��c���������(����)

A.a�ķе����
B.b���۵����
C.c��ƽ����Է����������
D.ÿһ����ֶ��Ǵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������б仯�У���I2���������ռ��ۻ����۶��������ۻ�����NaCl����ˮ����![]() Cl����ˮ������Ar�ۻ�����Na2O2����ˮ����
Cl����ˮ������Ar�ۻ�����Na2O2����ˮ����![]() aHSO4����ˮ��
aHSO4����ˮ��
��ѧ��δ�ƻ�����___��ֻ�й��ۼ����ƻ�����___��ֻ�����Ӽ����ƻ�����___�����ۼ������Ӽ�ͬʱ���ƻ�����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Fe2����I����Br���Ļ����Һ��ͨ���������������Һ���������ӵ����ʵ����仯��ͼ��ʾ����֪b��a��5���߶���ʾһ�ֺ����ᣬ�Ң�͢���ʾ�������к�����ͬ��Ԫ�ء�����˵����ȷ���ǣ� ��
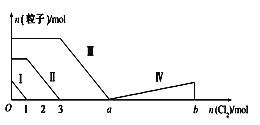
A.�߶��ʾBr-�ı仯���
B.ԭ��Һ��n(FeI2)��n(FeBr2)��3��1
C.����ͼ��������a��ֵ
D.�߶���ʾHIO3�ı仯���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ҫ�Ĺ�ҵԭ�ϣ���ũҵ��ҽҩ�������ͻ�������������ҪӦ�á�
��1�������ĵ���ʽΪ___�����Ĺ��ۼ�����___(����ԡ��Ǽ��ԡ�)����������ˮ�Լ��Ե������ǣ��û�ѧ����ʽ��ʾ��___��
��2����ҵ����N2��H2��һ�������ºϳɰ������д�ʩ��ʹ����Ӧ����������һ��ʹƽ��������NH3����������������___��
A�����ͷ�Ӧ�¶� B��ѹ����Ӧ����� C������N2 D��Һ������NH3
��3�������£���100mL0.2mol/L�İ�ˮ����μ���0.2mol/L�����ᣬ������Һ��pH����Һ��NH4+��NH3��H2O�����ʵ���������������������Ĺ�ϵ��ͼ��ʾ��
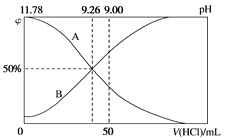
��ʾNH3��H2OŨ�ȱ仯��������___(�A����B��)��
��4���������������Ϊ50mLʱ����Һ��c(NH4+)��c(NH3��H2O)=___mol/L(�����ֱ�ʾ)����Һ����Ҳ��������ˮ�ĵ���(H2O��H2O![]() H3O����OH��)��̼��������Һ����Ҳ�ܷ�����ȫ���������ˮ��İ��⡣
H3O����OH��)��̼��������Һ����Ҳ�ܷ�����ȫ���������ˮ��İ��⡣
��д��Һ���ĵ��뷽��ʽ��___��
��д��̼��������Һ�����һ����������ӷ���ʽ��___��
��д��̼���Ƶ�Һ����Һ�и�����Ũ�ȵĴ�С��ϵ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������NF3�����������ӹ�ҵ���������·�Ӧ�Ʊ���4NH3+3F2��NF3+3NH4F������˵���У���ȷ���ǣ� ��
A.NF3�ĵ���ʽΪ![]()
B.NH4F�����н������Ӽ�
C.���Ʊ�NF3�ķ�Ӧ�У�NH3���ֳ���ԭ��
D.���Ʊ�NF3�ķ�Ӧ����ʽ�У������ʾ�Ϊ���ۻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I�����л�ԭ�ԣ�����ʳ���еĵ�Ԫ����Ҫ��KIO3����ʽ���ڣ�I����I2��IO3����һ�������¿ɷ�����ͼת����ϵ������˵������ȷ����
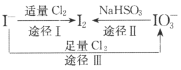
A.�õ��ۣ�KI��ֽ��ʳ�ɼ���ʳ���Ƿ�ӵ�
B.��ͼ��֪�����Ե�ǿ��˳��ΪC12��IO3����I2
C.���������ĵ⣬;��I��;����ת�Ƶ�����Ŀ֮��Ϊ2��5
D.;����Ӧ�����ӷ���ʽ��3C12+I��+3H2O=6C1��+IO3��+6H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ѧ��ӦA2(g)+B2(g)=2AB(g)�������仯��ͼ��ʾ���ж�������������ȷ����

A.ÿ����2����AB����b kJ����
B.�÷�Ӧ�ķ�Ӧ�Ȧ�H= +(a-b)kJ��mol-1
C.�÷�Ӧ�з�Ӧ��������������������������
D.����1mol A-A����1mol B-B�����ų�a kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�����ͣ�Jabir ibn Hayyan�ڸ�����ʯ�Ĺ������״η��ֲ��Ƶ�����(4KNO3![]() 2K2O+4NO��+3O2��)��ͬʱ��Ҳ���������ˮ�ķ����ߡ�����˵����ȷ����
2K2O+4NO��+3O2��)��ͬʱ��Ҳ���������ˮ�ķ����ߡ�����˵����ȷ����
A. ��������Ļ�����������Ͽɱ�ˮ��ȫ����
B. ��ˮ����3���Ũ������1���Ũ�������ƶ��ɵ�
C. ��ˮ�ܽ��ʱ�����е�������������(Au+HNO3+4HCl=H[AuCl4]+NO��+2H2O)
D. ʵ���ҿ���NaNO3��Ũ���ᷴӦ�Ʊ�������HNO3�����õ���Ũ�����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com