
【题目】如图是石油分馏塔的示意图,a、b、c三种馏分中( )

A.a的沸点最高
B.b的熔点最低
C.c的平均相对分子质量最大
D.每一种馏分都是纯净物
【答案】C
【解析】
在分馏塔中,位置越高温度越低,石油蒸气在上升途中会逐步液化、冷却及凝结成液体馏分,易挥发的沸点较低、较轻的馏分先出来,一定在最高处,也就是说分馏塔中出口越低,分馏出的馏分的沸点越高;a先分馏出来,c较a、b最后分馏出来,故熔沸点高低顺序为a<b<c,熔沸点越高,烃中含碳原子数越多,平均分子量越大,即相对分子质量a<b<c;
A.熔沸点高低顺序为a<b<c,a处的馏分为汽油,故a的沸点最低,故A错误;
B.熔沸点高低顺序为a<b<c,b处的馏分为煤油,故b的熔点不是最低,故B错误;
C.a先分馏出来,c较a、b最后分馏出来,故熔沸点高低顺序为a<b<c,熔沸点越高,烃中含碳原子数越多,平均分子量越大,即相对分子质量a<b<c,故C正确;
D.从分馏塔各个出口出来的馏分都为混合物,故D错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】镍是有机合成的重要催化剂。
(1)基态镍原子的价电子排布式___________________________。
(2)镍和苯基硼酸共催化剂实现了丙烯醇(CH2=CH—CH2OH)的绿色高效合成,丙烯醇中碳原子的杂化类型有______________________;丙醛(CH3CH2CHO)与丙烯醇(CH2=CH—CH2OH)分子量相等,但丙醛比丙烯醇的沸点低的多,其主要原因是________________________。
(3)羰基镍[Ni(CO)4]用于制备高纯度镍粉。羰基镍[Ni(CO)4]中Ni、C、O 的电负性由大到小的顺序为______。
(4)Ni2+ 能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]- 等。NH3的空间构型为_______;
(5)“NiO”晶胞如图:
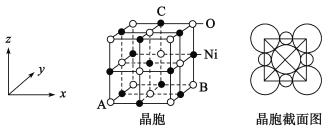
①氧化镍晶胞中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为_____________;
②已知氧化镍晶胞密度dg/cm3,NA 代表阿伏加德罗常数的值,则Ni2+ 半径为________nm(用代数式表示)。(Ni的相对于原子质量是59)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在等体积①pH=1的硫酸;②0.01mol·L-1NaOH溶液;③pH =10的纯碱溶液中;水电离程度的大小顺序是( )
A.①>②>③B.②>①>③C.③>①>②D.③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的有( )个
①反应速率用于衡量化学反应进行的快慢
②可逆反应达到化学平衡状态时,正、逆反应速率都为0
③决定反应速率的主要因素是反应物的性质
④适当增大反应物浓度,提高反应温度都能增大反应速率
⑤不管什么反应使用催化剂,都可以加快反应速率 ,并可以使平衡移动。
⑥可逆反应A(g)![]() B(g)+C(g),增大压强,正反应速率减小,逆反应速率增大
B(g)+C(g),增大压强,正反应速率减小,逆反应速率增大
⑦对达到平衡的一个放热的可逆反应,若降温,则正反应速率减小,逆反应速率增大
A. 2 个 B. 3 个 C. 4 个 D. 5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用含有![]() 和
和![]() 的废水回收铬.其工艺流程如图:
的废水回收铬.其工艺流程如图:
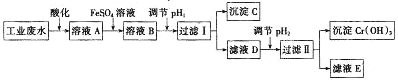
已知:![]() 黄色
黄色![]() 橙色
橙色![]() ;
;
![]() 常温下,
常温下,![]() ,
,![]() ;
;
![]() 当离子浓度小于
当离子浓度小于![]()
![]() 时,认为沉淀完全.
时,认为沉淀完全.
![]() 酸化后的溶液A显 ______ 色.
酸化后的溶液A显 ______ 色.
![]() 下列选项中,能说明反应
下列选项中,能说明反应![]() 黄色
黄色![]() 橙色
橙色![]() 达到平衡状态的是 ______
达到平衡状态的是 ______ ![]() 填选项字母
填选项字母![]() ;
;
![]() 和
和![]() 的浓度相同
的浓度相同![]() 溶液的颜色不变
溶液的颜色不变![]() 溶液的pH不变
溶液的pH不变
![]() 为防止
为防止![]() 溶液变质,在保存时需加入的试剂为 ______
溶液变质,在保存时需加入的试剂为 ______ ![]() 填试剂名称
填试剂名称![]() .
.
![]() 过滤操作中需要用到的玻璃仪器有 ______ .
过滤操作中需要用到的玻璃仪器有 ______ .
![]() 溶液与溶液A发生反应的离子方程式为 ______ .
溶液与溶液A发生反应的离子方程式为 ______ .
![]() 沉淀C的化学式为 ______ ,
沉淀C的化学式为 ______ ,![]() 的范围为 ______ .
的范围为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)“元时,南安有黄长者,为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之。”泥土能将红糖变白糖,其表现的性质是__________。
(2)用鸡蛋壳膜和蒸馏水可除去淀粉胶体中的食盐,其原理是______________。
(3)欲使![]() 全部转化为
全部转化为![]() ,则需要氧化剂
,则需要氧化剂![]() (还原产物为
(还原产物为![]() )至少_______
)至少_______![]() 。
。
(4)下列变化为化学变化的是_________(填字母)。
A.![]() 的潮解 B.铁的生锈 C.新制氯水久置后颜色变浅
的潮解 B.铁的生锈 C.新制氯水久置后颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握化学的基本概念和研究方法才能学好化学。按要求回答下列问题:
(1)下列是对碱、酸、盐、氧化物的分类列表:
碱 | 酸 | 盐 | 氧化物 | |
第一组 |
|
|
|
|
第二组 |
|
|
|
|
第三组 |
|
|
|
|
表中每组均有物质分类错误,三组中对应分类错误的物质分别是_________、_________、_________。(填化学式)
(2)![]() 固体不能导电,而
固体不能导电,而![]() 溶液可以导电,原因是_________________________。
溶液可以导电,原因是_________________________。
(3)依据下列两个反应,按要求填空。
Ⅰ.![]()
Ⅱ.![]()
反应Ⅰ和反应Ⅱ中,![]() 只作氧化剂的反应是________(填“Ⅰ”或“Ⅱ”);反应Ⅱ中,每生成标准状况下
只作氧化剂的反应是________(填“Ⅰ”或“Ⅱ”);反应Ⅱ中,每生成标准状况下![]() ,反应中转移________
,反应中转移________![]() 电子;
电子;![]() 和
和![]() 都能使澄清石灰水变浑浊,请设计一种方法检验
都能使澄清石灰水变浑浊,请设计一种方法检验![]() 、
、![]() 混合气体中的
混合气体中的![]() :_____________。
:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅材料在工业生产中具有重要的应用,下列说法正确的是( )
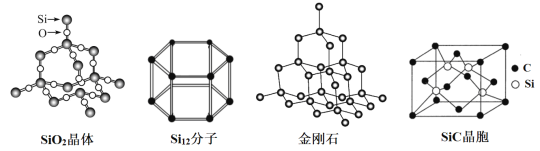
A.熔沸点比较:金刚石<SiC
B.SiC中Si原子的配位数为4
C.Si12与单晶硅互为同分异构体
D.1molSiO2中含有2molSi-O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据最高能层的符号是________,占据该能层电子的电子云轮廓图形状为________________。
(3)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能(kJ/mol) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是________价,其基态原子电子排布式为____________
(4)PO43-的中心原子的杂化方式为__________,键角为_______________
(5)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为________________
(6)下列元素或化合物的性质变化顺序正确的是__________________
A.第一电离能:Cl>S>P>Si B.共价键的极性:HF>HCI>HBr>HI
C.晶格能:NaF>NaCl>NaBr>NaI D.热稳定性:MgCO3>CaCO3>SrCO3>BaCO3
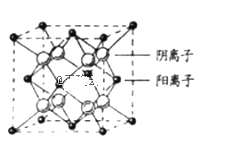
(7)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_____________;已知Ca2+和F-半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为___________________g·cm-3(不必化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com