
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A.每生成2分子AB吸收b kJ热量
B.该反应的反应热ΔH= +(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1mol A-A键和1mol B-B键,放出a kJ能量
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】为了清理路面积雪,人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54mol电子。
(1)该融雪剂的化学式是____,该物质中化学键类型是______,电子式是______。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是__________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为_________,电子式为_______,化学键类型为_________(填“离子键”“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成____,其化学键类型为___;加热时生成_____,其化学键类型为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀废水沉泥中含Cu、Ni、Ag和Fe等多种元素的有机金属盐,采用焙烧一浸出—分离回收的工艺流程可有效分离电镀废水沉泥中的金属,其流程如下:
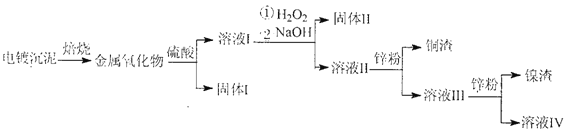
下列叙述错误的是
A. 上述流程中硫酸可以用稀盐酸代替
B. “固体Ⅱ”为Fe(OH)2
C. 溶液III中含有Na+、Ni2+、Zn2+等金属离子
D. 合理处理电镀废沉泥可实现资源的回收与可持续利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量变化的说法正确的是( )
A.冰融化成水放出热量
B.生成物的总能量一定低于反应物的总能量
C.金属与酸反应生成氢气的过程吸收热量
D.化学键的断裂和形成是化学反应中能量变化的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,其中X、Y、Z 三种元素中,可形成含二种元素的10电子微粒m、n、p、q,且有反应m+n![]() p
p![]() +q;M的最高价氧化物对应的水化物为最强酸。则下列说法正确是
+q;M的最高价氧化物对应的水化物为最强酸。则下列说法正确是
A. 原子半径X<M<Z<Y B. 非金属性X <M<Z<Y
C. X、Y、Z三种元素组成的化合物的水溶液一定呈酸性 D. MZ2可用于自来水的杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g) + O2(g)![]() 2SO3(g) ΔH = a kJ·mol-1,反应能量变化如图所示。下列说法中,不正确的是
2SO3(g) ΔH = a kJ·mol-1,反应能量变化如图所示。下列说法中,不正确的是

A.a<0
B.过程II可能使用了催化剂
C.使用催化剂可以提高SO2的平衡转化率
D.反应物断键吸收能量之和小于生成物成键释放能量之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家已经发明利用眼泪,检测糖尿病的装置,其原理是用氯金酸钠(NaAuCl4·2H2O)溶液与眼泪中的葡萄糖反应生成纳米金单质颗粒。下列有关说法不正确的是( )
A.葡萄糖不能发生水解反应
B.葡萄糖属于单糖
C.检测时NaAuCl4发生氧化反应
D.葡萄糖可以通过绿色植物的光合作用合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

(1)定性如图甲可通过观察______的快慢,定性比较得出结论。有同学提出将0.1mol/L FeCl3改为____mol/L Fe2(SO4)3更为合理,其理由是____。
(2)定量如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是_____。
(3)查阅资料得知:将作为催化剂的Fe2(SO4)3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是:2Fe3++H2O2=2Fe2++O2↑+2H+和__________。
II.欲用下图所示实验来证明MnO2是H2O2分解反应的催化剂。
(1)该实验不能达到目的,若想证明MnO2是催化剂还需要确认__________。

加入0.10mol MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如下图所示。

(2)写出H2O2在二氧化锰作用下发生反应的化学方程式_________。
(3)A、B、C、D各点反应速率快慢的顺序为______>______>______>______,解释反应速率变化的原因__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知单质硫是淡黄色固体粉末,难溶于水。实验室制氯气的反应原理为:![]() ,为了比较氯元素和硫元素的非金属性强弱,某化学实验小组设计了如下实验,请回答下列问题:
,为了比较氯元素和硫元素的非金属性强弱,某化学实验小组设计了如下实验,请回答下列问题:

(1)仪器X的名称:_______。
(2)用饱和食盐水除去A中生成Cl2中的杂质气体 _____。(填杂质气体化学式)
(3)碳元素比氯元素的非金属性______(填“强”或者“弱”)。
(4)装置B中盛放的试剂是Na2S溶液,实验中可观察到的现象是______。
(5)装置C燃烧碱稀释液,目的是吸收剩余气体,原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com