
| A. | 大力勘探和开采石油 | |
| B. | 多利用天然气少使用石油 | |
| C. | 因为煤的储量比石油丰富,应多使用煤作能源 | |
| D. | 大力发展核能、氢能并充分利用太阳能 |
科目:高中化学 来源: 题型:选择题
| A. | ④③②① | B. | ①④②③ | C. | ③①④② | D. | ①④③② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 每生成2分子AB吸收bkJ热量 | |
| B. | 该反应热△H=(a-b) kJ•mol-1 | |
| C. | 该反应中反应物的总能量高于生成物的总能量 | |
| D. | 断裂1molA-A键和1molB-B键,放出akJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①③④⑤ | C. | ②⑥⑦ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
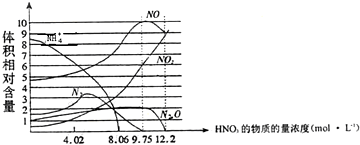
| A. | 一般来说,硝酸与铁反应的还原产物不是单一的 | |
| B. | 用一定量的铁粉与大量的9.75mol•L-1HNO3溶液反应得到标态下气体2.24L,则参加反应的硝酸的物质的量为0.1mol. | |
| C. | 硝酸的浓度越大,其还原产物中价态越高的成份越多 | |
| D. | 当硝酸浓度为9.75mol•L-1时还原产物是NO、NO2、N2O,且其物质的量之比为5:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
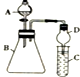 某同学利用如图装置探究同主族元素非金属性的变化规律.
某同学利用如图装置探究同主族元素非金属性的变化规律.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑧ | B. | ④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
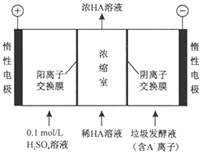 对生活污水进行处理是防止水体污染、改善水质的主要措施.电渗析法处理厨房垃圾发酵液(含污染物乳酸跟离子)同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子).下列叙述中正确的是( )
对生活污水进行处理是防止水体污染、改善水质的主要措施.电渗析法处理厨房垃圾发酵液(含污染物乳酸跟离子)同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子).下列叙述中正确的是( )| A. | 阴极区溶液的pH变小 | |
| B. | 阳极的电极反应式为2H2O-4e-═4H++O2↑ | |
| C. | 通过一段时间后浓缩至水的量减少,导致乳酸溶液浓度上升 | |
| D. | 若阳、阴离子交换膜调换位置,与如图可以达到相同的效果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com