
| 物质 组别 | 甲 | 乙 | 丙 |
| A | FeCl2 | Cl2 | NaOH |
| B | SiO2 | NaOH | HF |
| C | AlCl3 | KOH | H2SO4 |
| D | SO2 | NaOH | NaHCO3 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、C2H4、C2H6O |
| B、C2H2、C6H6 |
| C、CH2O、C3H6O |
| D、CH4、C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 系统命名为
系统命名为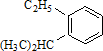 的炔烃的结构简式
的炔烃的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 25°C时,取浓度均为0.1mol?L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol?L-1NaOH溶液、0.1mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25°C时,取浓度均为0.1mol?L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol?L-1NaOH溶液、0.1mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A、曲线I中滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B、曲线I中滴加溶液到25 mL时:c(NH4+)>c(C1-)>c(H+)>c(OH-) |
| C、曲线II中滴加溶液在10 mL~25 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D、曲线II中滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,水分解产生O2,此时平衡常数的值约为5×10-80 | ||
| B、常温下,最易分解放出O2的是水 | ||
C、K3=
| ||
| D、以上都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是K层上电子数的3倍 |
| Q | Q原子的质子数比T原子的核外电子数少3 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀HNO3和金属反应时主要得到氢气 |
| B、NH3易液化,液氨常用作制冷剂 |
| C、利用氨气极易溶于水,氨气可以做喷泉实验 |
| D、铵盐受热易分解,贮存氨态氮肥时要密封保存,并放在阴凉通风处 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com