
 见图,接通电源,观察食盐水发生的变化.看见石墨棒一端产生黄绿色气体,然后用湿润的淀粉碘化钾试纸检验,试纸变蓝.通电前往U形管两端各滴入几滴酚酞试液,通电一段时间后,左侧U形管溶液颜色变红.
见图,接通电源,观察食盐水发生的变化.看见石墨棒一端产生黄绿色气体,然后用湿润的淀粉碘化钾试纸检验,试纸变蓝.通电前往U形管两端各滴入几滴酚酞试液,通电一段时间后,左侧U形管溶液颜色变红.
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
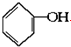 合成
合成 :
:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向 苯粉钠溶液中通入少量的CO2:2C6H5O+CO2+H2O→2C6H5OH+CO32- | ||||
| B、铝溶于氢氧化钠溶液:Al+2OH-+H2O═AlO2-+2H2↑ | ||||
| C、NH4HSO4和过量的氧化钠溶液反应:NH4++OH-═NH3H2O | ||||
D、用惰性电极电解硫酸铜溶液:2C2++2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:

| 化学式 | 键长/nm | 键角 | 沸点/℃ |
| H2S | 1.34 | 92.3° | -60.75 |
| H2Se | 1.47 | 91.0° | -41.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlO2-,Ba2+,Mg2+ |
| B、Ag+,Ca2+,Al3+ |
| C、Ag+,Mg2+,Na+ |
| D、AlO2-,Na+,Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烷与Cl2在光照条件下发生取代反应 |
| B、分子式为C5H12O的醇被灼热的CuO氧化 |
| C、分子式为C4H8的烯烃与HCl在一定条件下发生加成反应 |
| D、分子式为C5H10O2的酸与分子式为C4H10O的醇发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、平均摩尔质量:M(a)>M(c),M(b)>M(d) |
| B、正反应速率:v(a)>v(c),v(b)>v(d) |
| C、平衡常数:K(a)>K(c),K(b)>K(d) |
| D、温度:T1>T2>T3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com