
【题目】在一定温度下,10L密闭容器中加入5molSO2、4.5molO2 , 经10min后反应达平衡时,有3molSO2发生了反应.试回答下列问题:
(1)O2的转化率为多少?
(2)用SO2表示该反应的反应速率为多少?
(3)平衡时容器内气体压强与反应前的压强之比为多少?(最简整数比)
(4)平衡时体系中SO3的百分含量(体积分数)为多少?
(5)平衡常数K为多少?
(6)若向平衡混合物的容器中通人少量氦气后,化学平衡如何移动?
【答案】
(1)解:10L密闭容器中加入5.0molSO2、4.5molO2,c(SO2)= ![]() =0.50mol/L,c(O2)=
=0.50mol/L,c(O2)= ![]() =0.45mol/L,经10min后反应达平衡时反应的SO2的浓度=
=0.45mol/L,经10min后反应达平衡时反应的SO2的浓度= ![]() =0.30mol/L,
=0.30mol/L,
则
2SO2 | + | O2 | 2SO3 | ||
起始浓度(mol/L) | 0.50 | 0.45 | 0 | ||
变化浓度(mol/L) | 0.30 | 0.15 | 0.3 | ||
平衡浓度(mol/L) | 0.20 | 0.30 | 0.3 |
氧气的转化率= ![]() ×100%=
×100%= ![]() ×100%=33.3%,
×100%=33.3%,
答:氧气的转化率是33.3%
(2)解:v(SO2)= ![]() =
= ![]() =0.03 mol/(L.min),
=0.03 mol/(L.min),
答:二氧化硫的反应速率是0.03 mol/(L.min)
(3)解:
2SO2 | + | O2 | 2SO3 | ||
起始浓度(mol/L) | 5 | 4.5 | 0 | ||
变化浓度(mol/L) | 3 | 1.5 | 3 | ||
平衡浓度(mol/L) | 2 | 3 | 3 |
恒温恒容下,气体压强之比等于其物质的量之比,所以平衡时压强与反应初始压强之比=(2+3+3)mol:(5+4.5)mol=16:19,
答:平衡时容器内气体压强与反应前的压强之比为16:19
(4)解:恒温恒容下,气体压强之比等于其物质的量之比,所以气体压强所占分数等于气体的物质的量所占分数,
所以平衡时三氧化硫体积分数百分含量= ![]() =37.5%,
=37.5%,
答:平衡时三氧化硫体积分数为37.55
(5)解:化学平衡常数K= ![]() =
= ![]() =7.5,
=7.5,
答:化学平衡常数K为7.5
(6)解:恒容条件下通入少量He后二氧化硫、氧气、三氧化硫浓度不变,正逆反应速率不变且相等,所以化学平衡不移动,答:若向平衡混合物的容器中通人少量氦气后,化学平衡不移动
【解析】10L密闭容器中加入5.0molSO2、4.5molO2 , c(SO2)= ![]() =0.50mol/L,c(O2)=
=0.50mol/L,c(O2)= ![]() =0.45mol/L,经10min后反应达平衡时反应的SO2的浓度=
=0.45mol/L,经10min后反应达平衡时反应的SO2的浓度= ![]() =0.30mol/L,
=0.30mol/L,
则
2SO2 | + | O2 | 2SO3 | ||
起始浓度(mol/L) | 0.50 | 0.45 | 0 | ||
变化浓度(mol/L) | 0.30 | 0.15 | 0.3 | ||
平衡浓度(mol/L) | 0.20 | 0.30 | 0.3 |
第(1)问:氧气的转化率= ![]() ×100%;第(2)问:v(SO2)=
×100%;第(2)问:v(SO2)= ![]() ;第(3)问:恒温恒容下,气体压强之比等于其物质的量之比;第(4)问:恒温恒容下,气体压强之比等于其物质的量之比,所以气体压强所占分数等于气体的物质的量所占分数;第(5)问:化学平衡常数K=
;第(3)问:恒温恒容下,气体压强之比等于其物质的量之比;第(4)问:恒温恒容下,气体压强之比等于其物质的量之比,所以气体压强所占分数等于气体的物质的量所占分数;第(5)问:化学平衡常数K= ![]() ;第(6)问:恒容条件下通入少量He后二氧化硫、氧气、三氧化硫浓度不变,化学平衡不移动.
;第(6)问:恒容条件下通入少量He后二氧化硫、氧气、三氧化硫浓度不变,化学平衡不移动.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】在给定条件下,下列划横线的物质在化学反应中能被完全消耗的是( )
A.标准状况下,将1g铝片投入20mL 18.4molL﹣1的硫酸中
B.向100mL3moIL﹣1的硝酸中加入5.6g铁
C.用50mL18molL﹣1浓硫酸与足量Cu共热(指其中的硫酸被完全消耗)
D.在5×107 Pa、500℃和铁触媒催化的条件下,用3mol氢气和2mol氮气合成氨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B3C+4D中,表示该反应速率最快的是( )
A.v(A)=0.7molL﹣1S﹣1
B.v(B)=0.3 molL﹣1S﹣1
C.v(C)=0.8molL﹣1S﹣1
D.v(D)=1 molL﹣1S﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“探险队员”﹣﹣盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过.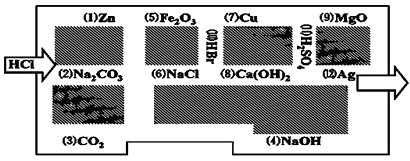
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线) .
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有个,属于氧化还原反应的有个,其中能“吃掉”盐酸的盐是 , 写出该反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,图为蒸馏实验装置.
(1)写出下列仪器的名称:a. b.;
(2)若利用该装置分离四氯化碳和酒精的混合物,还缺少的仪器是 .
(3)某粗盐除含氯化钠外,还混有可溶性CaCl2、MgCl2、硫酸盐、泥砂等不溶性杂质,为提纯粗盐,可选用以下试剂及操作先后顺序可以是 (填选项字母)
①Na2CO3②NaOH ③BaCl2④HCl ⑤过滤 ⑥蒸发结晶,
A.②③①④⑤⑥
B.②③①⑤④⑥
C.②①③⑤④⑥
D.③②①⑤④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示在密闭容器中反应:2SO2+O22SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是;b c过程中改变的条件可能是; 若增大压强时,反应速度变化情况画在c~d处. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1molL﹣1NaOH溶液中加入0.1molL﹣1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( ) 
A.HA为强酸
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A﹣)>c(HA)
D.pH=7时,c(Na+)=c(A﹣)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂化学计量数为1:2的是( )
A.Fe+2HCl═FeCl2+H2↑
B.2HCl+Ca(ClO)2═2HClO+CaCl2
C.I2+2NaClO3═2NaIO3+Cl2↑
D.4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com