
【题目】下图是元素周期表的一部分,根据① ~ ⑨在周期表中的位置按题目要求回答:
族 周期 | IA | 0 | ||||||||
1 | ⅡA | …… …… …… | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
2 | ① | ② | ||||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||||
4 | ⑧ | ⑨ | ⑩ | |||||||
(1)画出⑩的原子结构示意图_________________________
(2)①与②形成的一种化合物甲,甲在大气含量过高会产生温室效应,写出甲物质的结构式 __________________________________。
(3)元素③⑤对应的最高价氧化物的水化物,写出它们相互之间能发生反应化学方程式__________________。
(4)元素⑦和⑨形成的化合物乙,请用电子式表示物质乙的形成过程__________________。
(5)②、⑥分别形成的两种氢化物中,沸点较高的是______(填化学式),原因是:___________________________________________________ 。
【答案】 O=C=O NaOH+Al(OH)3=NaAlO2+2H2O
O=C=O NaOH+Al(OH)3=NaAlO2+2H2O  H2O 水分子中含有氢键,故水的沸点高于硫化氢
H2O 水分子中含有氢键,故水的沸点高于硫化氢
【解析】
根据元素周期表得出①为C、②为O、③为Na、④为Mg、⑤为Al、⑥为S、⑦为Cl、⑧为K、⑨为Ca、⑩为Br,然后分析。
(1)⑩为Br,原子序数为35,原子结构示意图为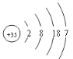 ;
;
(2)①与②形成的一种化合物甲,甲在大气含量过高会产生温室效应,甲物质为二氧化碳,碳与每个氧共用两对电子,其结构式为O=C=O;
(3)元素③⑤对应的最高价氧化物的水化物分别为NaOH、Al(OH)3,NaOH与Al(OH)3反应生成NaAlO2,它们相互之间能发生反应化学方程式NaOH+Al(OH)3=NaAlO2+2H2O;
(4)元素⑦和⑨形成的化合物乙为CaCl2,电子式表示物质乙的形成过程是两个氯原子和一个钙原子反应生成CaCl2,电子式表示物质乙的形成过程 ;
;
(5)②、⑥分别形成的两种氢化物分别是水和硫化氢,都是分子晶体,硫化氢分子间主要存在范德华力,但水分子中含有氢键,故水的沸点高于硫化氢。


科目:高中化学 来源: 题型:
【题目】某高聚物的结构片断如下:
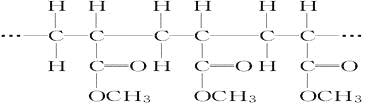
下列分析正确的是( )
A. 它是缩聚反应的产物B. 其单体是CH2=CH2和HCOOCH3
C. 其链节是CH3CH2COOCH3D. 其单体是CH2=CHCOOCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用下图装置探究草酸亚铁晶体(FeC2O4·2H2O)的分解产物,下列说法错误的是
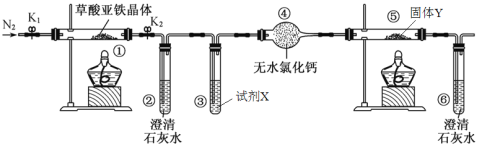
A. 实验前通入N2的作用是排出装置内的空气
B. ②、⑥中澄清石灰水的作用均是为了检验CO2气体
C. 装置中试剂X为NaOH溶液,固体Y为CuO固体
D. 将①中所得固体溶于KSCN溶液,可以检验其中铁元素的化合价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家开发出了多种太阳能电池,除晶体硅太阳能电池外,还有GaAs太阳能电池、铜铟镓硒薄膜太阳能电池等。
(1)基态Ga原子的电子排布式为________。
(2)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因________________。
(3)H2Se分子的键角_______H2O分子的键角(选填“>”、“=”或“<”)。写出与SeO3互为等电子体的一种阴离子_____________(写化学式)。
(4) AsF3分子的立体构型为__________;AsF3是极性分子,理由是_________________。
(5)Ga(OH)3与NaOH溶液反应生成Na[Ga(OH)4]。Na[Ga(OH)4]溶液中含有的化学键有__________________。
A.共价键 B.离子键 C.金属键 D.配位键 E.氢键
(6)金刚砂(SiC)晶胞如图所示:
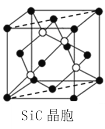
金刚砂中硅原子的杂化轨道类型为_______,沿晶胞图中虚线方向的切面图为__________(填标号)。
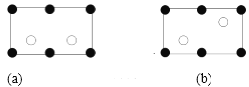
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2可用作食品添加剂。NaNO2能发生以下反应:3NO2-+2H+=NO3-+2NO↑+H2O
NO2-+Ag+=AgNO2↓(淡黄色)
某化学兴趣小组进行以下探究。回答有关问题:
(l)制取NaNO2反应原理:Na2CO3+2NO2=NaNO2+NaNO3+CO2 Na2CO3+NO+NO2=2NaNO2+CO2
用下图所示装置进行实验。
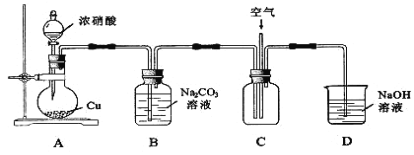
①铜与浓硝酸反应的化学方程式为______________________________。
②实验过程中,需控制B中溶液的pH>7,否则产率会下降,理由是_________。
③往C中通入空气的目的是____________________(用化学方程式表示)。
④反应结束后,B中溶液经蒸发浓缩、冷却结品、___________ 等操作,可得到粗产品晶体和母液。
(2)测定粗产品中NaNO2的含量
称取5.000g粗产品,溶解后稀释至250mL。取出25.00 mL溶液,用0.1000 mol·L-1KMNO4酸性溶液平行滴定三次,平均消耗的体积为20.00mL。已知:2MnO4-+6H++5NO2-=5NO3-+2Mn2++3H2O
①稀释溶液时,需使用的玻璃仪器除烧杯、玻璃棒外,还有 _________(填标号)。
A.容量瓶 B.量筒 C.胶头滴管 D.锥形瓶
②当观察到_________________时,滴定达到终点。
③粗产品中NaNO2的质量分数为____________ (用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时NO(g)和O2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应,在第5s时,NO的转化率为________。
(2)如图中表示O2变化曲线的是________,用O2表示从0~2s内该反应的平均速率v=________。
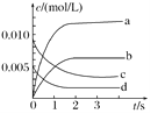
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内气体总质量保持不变
c.v逆(NO)=2v正(O2) d.容器内气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiHCl3在催化剂作用下主要发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g) ΔH=+48kJ·mol-1。已知:反应速率
SiH2Cl2(g)+SiCl4(g) ΔH=+48kJ·mol-1。已知:反应速率![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。

下列说法正确的是( )
A.343K时反应物的平衡转化率为21%
B.a点的反应速率小于b点的反应速率
C.343K时![]() =
=![]()
D.由323K的平衡转化率数据,不能计算323K的平衡常数K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷燃烧热为890.3 kJmol-1,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=+890.3 kJmolˉ1
B.稀盐酸和稀氢氧化钠溶液混合,其热化学方程式为:H++OH-=H2O △H=-57.3 kJmolˉ1
C.H2燃烧热为285.8kJmolˉ1,燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1) △H=-571.6 kJmolˉ1
D.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJ·mol-1
2NH3(g) △H=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2,SnCl2等还原制得:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:
2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:  。
。
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_____;H、N、O三种元素的电负性由大到小的顺序是____。
(2)SO2分子的空间构型为________;与SnCl4互为等电子体的一种离子的化学式为________。
(3)乙二胺分子中氮原子轨道的杂化类型为________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是__________。
(4)②中所形成的配离子中含有的化学键类型有______(填字母)。
A.配位键 B.极性键 C.离子键 D.非极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com