
【题目】科学家开发出了多种太阳能电池,除晶体硅太阳能电池外,还有GaAs太阳能电池、铜铟镓硒薄膜太阳能电池等。
(1)基态Ga原子的电子排布式为________。
(2)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因________________。
(3)H2Se分子的键角_______H2O分子的键角(选填“>”、“=”或“<”)。写出与SeO3互为等电子体的一种阴离子_____________(写化学式)。
(4) AsF3分子的立体构型为__________;AsF3是极性分子,理由是_________________。
(5)Ga(OH)3与NaOH溶液反应生成Na[Ga(OH)4]。Na[Ga(OH)4]溶液中含有的化学键有__________________。
A.共价键 B.离子键 C.金属键 D.配位键 E.氢键
(6)金刚砂(SiC)晶胞如图所示:
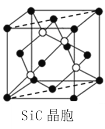
金刚砂中硅原子的杂化轨道类型为_______,沿晶胞图中虚线方向的切面图为__________(填标号)。
【答案】[Ar]3d104s24p1 Cu2+的价电子排布为3d9,而Cu+为3d10的全充满稳定结构 < CO32-、NO3- 三角锥形 分子中正、负电荷中心不重合 AD sp3 a
【解析】
(1)Ga是31号元素,根据构造原理,书写其核外电子排布式;
(2)原子核外电子所处的轨道为全满、半满、全空时是稳定结构,根据Cu2+、Cu+的核外电子排布分析;
(3)根据中心原子的半径大小及电负性大小分析判断键角;根据等电子体是分子中原子数相同,最外层电子数也相同的特点推断;
(4)根据价层电子对数及含有的孤电子对数判断AsF3分子的立体构型;从分子的对称性判断分子是否为极性分子;
(5)在Na[Ga(OH)4]溶液电离为Na+、[Ga(OH)4]-,在OH-中的O-H键为极性共价键,在Ga与OH-存在配位键;
(6)根据Si原子最外层电子数及形成SiC中的化学键数目判断其杂化类型,结合图示判断沿晶胞图中虚线方向的切面图的形状。
(1)根据构造原理,31号元素Ga的核外电子排布式为[Ar]3d104s24p1;
(2)Cu+的核外电子排布式为1s22s22p63s23p63d10,其价电子排布式为:3d10,Cu2+的核外电子排布式为1s22s22p63s23p63d9,价电子排布式为:3d9,由于Cu+为3d10全充满更稳定,所以在高温下CuO能分解生成Cu2O;
(3)由于O原子半径比Se原子半径小,电负性大,使水滴在中的成键电子对更靠近中心原子,产生的排斥作用大,所以键角比H2Se中的大;
SeO3含有的原子数为4,最外层电子总数为24,则SeO3与互为等电子体的阴离子可以是CO32-或NO3-;
(4)AsF3的中性原子As原子的价层电子对数为3+![]() =4,且As原子上有一对孤电子对,所以AsF3分子的立体构型为三角锥形;在AsF3分子中,由于AsF3分子的立体构型为三角锥形,负电荷重心在F原子一侧,正电荷重心在As原子一侧,使得该物质分子中正、负电荷中心不重合,因此该分子为极性分子;
=4,且As原子上有一对孤电子对,所以AsF3分子的立体构型为三角锥形;在AsF3分子中,由于AsF3分子的立体构型为三角锥形,负电荷重心在F原子一侧,正电荷重心在As原子一侧,使得该物质分子中正、负电荷中心不重合,因此该分子为极性分子;
(5)在Na[Ga(OH)4]溶液中,Na[Ga(OH)4]电离为Na+、[Ga(OH)4]-,在OH-中的O-H键为极性共价键,Ga原子最外层有3个电子,因此在Ga与OH-存在配位键,所以在Na[Ga(OH)4]溶液中,存在的化学键有共价键、配位键,故合理选项是AD;
(6)由于Si原子最外层有4个电子,在SiC中,每个Si原子与四个相邻的C原子形成了4个的共价键,所以Si杂化轨道类型为sp3杂化,结合图示判断沿晶胞图中虚线方向的切面图的形状为a。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如下图是某种有机物分子的球棍模型图。图中的“棍”代表单键或双键,不同大小的“球”代表三种不同的短周期元素的原子。对该有机物的叙述不正确的是( )
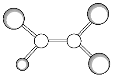
A.该有机物可能的分子式为C2HCl3
B.该有机物的分子中一定有![]()
C.该有机物分子中的所有原子在同一平面上
D.该有机物可以由乙烯和氯化氢加成反应得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A.图1表示某恒温密闭容器中反应CaCO3(s)![]() CaO(s)+CO2(g)达到平衡后,t1时刻压缩容器体积,CO2的物质的量浓度随时间的变化
CaO(s)+CO2(g)达到平衡后,t1时刻压缩容器体积,CO2的物质的量浓度随时间的变化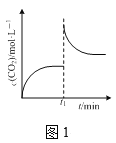
B.图2表示Ksp=1.0×10-12的CdCO3饱和溶液中,c(Cd2+)与c(CO32-)的关系曲线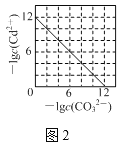
C.图3表示其他条件一定时,反应2SO2(g)+O2(g)![]() 2SO3(g)在有、无催化剂条件下SO3的物质的量随时间的变化曲线
2SO3(g)在有、无催化剂条件下SO3的物质的量随时间的变化曲线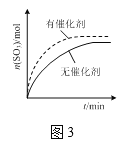
D.图4表示燃烧热为285.8kJ·mol-1的H2燃烧时能量的变化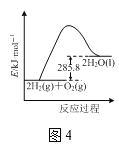
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将NO2和O2的混合气体12 mL通入足量水中,充分反应后剩余2 mL气体(同温同压下),则原混合气体中氧气的体积为( )
①1.2 mL ②2.4 mL ③3 mL ④4 mL
A.①②B.②③C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+等)为原料制备氧化锌的流程如下:
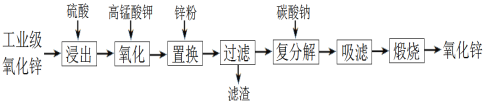
其中“氧化”加入KMnO4是为了除去浸出液中的Fe2+和Mn2+。下列有关说法错误的是
A. 浸出时通过粉碎氧化锌提高了浸出率
B. “氧化”生成的固体是MnO2和Fe(OH)3
C. “置换”加入锌粉是为了除去溶液中的Cu2+、Ni2+等
D. “煅烧”操作用到的仪器:玻璃棒、蒸发皿、泥三角
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)熔点-54.1℃、沸点69.2℃,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。
(1)SO2Cl2中S的化合价为_______,SO2Cl2在潮湿空气中因水解“发烟”的化学方程式为________________。
(2)现拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯,实验装置如图所示(夹持装置未画出)。
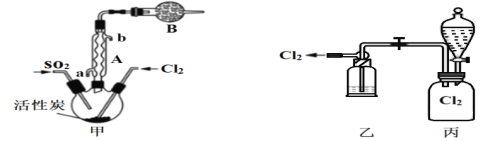
①仪器A的名称为___________,装置乙中装入的试剂_____________,装置B的作用是_______________________。
②装置丙分液漏斗中盛装的最佳试剂是________(选填字母)。
A.蒸馏水 B.10.0 mol/L浓盐酸
C.浓氢氧化钠溶液 D.饱和食盐水
(3)探究硫酰氯在催化剂作用下加热分解的产物,实验装置如图所示(部分夹持装置未画出)。
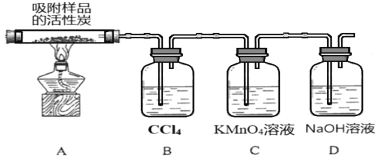
①加热时A中试管出现黄绿色,装置B的作用是 ____________。
②装置C中的现象是___________,反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,根据① ~ ⑨在周期表中的位置按题目要求回答:
族 周期 | IA | 0 | ||||||||
1 | ⅡA | …… …… …… | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
2 | ① | ② | ||||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||||
4 | ⑧ | ⑨ | ⑩ | |||||||
(1)画出⑩的原子结构示意图_________________________
(2)①与②形成的一种化合物甲,甲在大气含量过高会产生温室效应,写出甲物质的结构式 __________________________________。
(3)元素③⑤对应的最高价氧化物的水化物,写出它们相互之间能发生反应化学方程式__________________。
(4)元素⑦和⑨形成的化合物乙,请用电子式表示物质乙的形成过程__________________。
(5)②、⑥分别形成的两种氢化物中,沸点较高的是______(填化学式),原因是:___________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
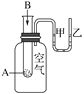
(1)该反应________(填“放出”或“吸收”)热量。
(2)如图能正确表示该反应中能量变化的是___________。
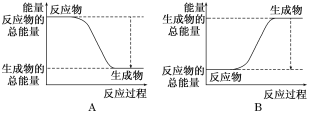
(3)写出一个符合题中条件的化学方程式:_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1:1。请回答:
(1)组成A分子的原子的核外电子排布式是________________;
(2)B的分子式分别是 ___________;C分子的立体结构呈_________ 形,该分子属于_____________分子(填“极性”或“非极性”);
(3)向D的稀溶液中加入少量氯化铁溶液,反应的化学方程式为_____________________________
(4) 若将1molE在氧气中完全燃烧,只生成1molCO2和2molH2O,则E的分子式是 __________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com