
ЁОЬтФПЁПЯТСаЭМЪОгыЖдгІЕФа№ЪіЯрЗћЕФЪЧЃЈ ЃЉ
A.ЭМ1БэЪОФГКуЮТУмБеШнЦїжаЗДгІCaCO3(s)![]() CaO(s)ЃЋCO2(g)ДяЕНЦНКтКѓЃЌt1ЪБПЬбЙЫѕШнЦїЬхЛ§ЃЌCO2ЕФЮяжЪЕФСПХЈЖШЫцЪБМфЕФБфЛЏ
CaO(s)ЃЋCO2(g)ДяЕНЦНКтКѓЃЌt1ЪБПЬбЙЫѕШнЦїЬхЛ§ЃЌCO2ЕФЮяжЪЕФСПХЈЖШЫцЪБМфЕФБфЛЏ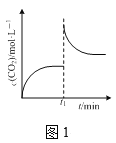
B.ЭМ2БэЪОKsp=1.0ЁС10-12ЕФCdCO3БЅКЭШмвКжаЃЌc(Cd2+)гыc(CO32-)ЕФЙиЯЕЧњЯп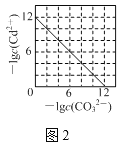
C.ЭМ3БэЪОЦфЫћЬѕМўвЛЖЈЪБЃЌЗДгІ2SO2(g)+O2(g)![]() 2SO3(g)дкгаЁЂЮоДпЛЏМСЬѕМўЯТSO3ЕФЮяжЪЕФСПЫцЪБМфЕФБфЛЏЧњЯп
2SO3(g)дкгаЁЂЮоДпЛЏМСЬѕМўЯТSO3ЕФЮяжЪЕФСПЫцЪБМфЕФБфЛЏЧњЯп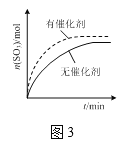
D.ЭМ4БэЪОШМЩеШШЮЊ285.8kJЁЄmol-1ЕФH2ШМЩеЪБФмСПЕФБфЛЏ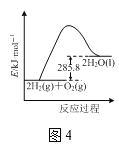
ЁОД№АИЁПB
ЁОНтЮіЁП
A.КуЮТЬхЯЕЃЌИУЗДгІЕФЦНКтГЃЪ§KБЃГжВЛБфЃЌK=C(CO2)ЃЌвђДЫбЙЫѕЬхЛ§жиаТДяЕНЦНКтЃЌЖўбѕЛЏЬМЕФХЈЖШгыЕквЛДЮЦНКтЕФХЈЖШЯрЕШЃЌAЯюДэЮѓЃЛ
B.ЭМ2 дкCdCO3БЅКЭШмвКжаЃЌc(Cd2+)гыc(CO32-)ГЩЗДБШЃЌЧвДјШыЪ§ОнЗћКЯCdCO3ЕФKsp=1.0ЁС10-12ЃЌBЯюе§ШЗЃЛ
C.ДпЛЏМСжЛФмИФБфЛЏбЇЗДгІЫйТЪЃЌВЛФмЪЙЦНКтвЦЖЏЃЌЙЪСНЬѕЧњЯпДяЕНЦНКтЕФзнзјБъЯрЕШЃЌCЯюДэЮѓЃЛ
D.ШМЩеШШЕФЖЈвхЪЧ1molПЩШМЮяЭъШЋЗДгІЩњГЩЮШЖЈбѕЛЏЮяЗХГіЕФШШжЕЃЌЭМ4БэЪОЕФ2molЧтЦјВЮгыЗДгІЃЌИУЗДгІЕФьЪБфЮЊ571.6 kJЁЄmol-1ЃЌDЯюДэЮѓЃЛ
Д№АИбЁBЁЃ


 УћаЃЭЈаажЄгааЇзївЕЯЕСаД№АИ
УћаЃЭЈаажЄгааЇзївЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїдзгЛђРызгЕФЕчзгХХВМЪНДэЮѓЕФЪЧЃЈЁЁЁЁ ЃЉ
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГИпОлЮяЕФНсЙЙЦЌЖЯШчЯТЃК
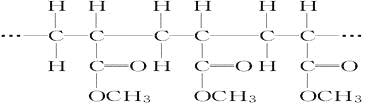
ЯТСаЗжЮіе§ШЗЕФЪЧ(ЁЁЁЁ)
A. ЫќЪЧЫѕОлЗДгІЕФВњЮяB. ЦфЕЅЬхЪЧCH2=CH2КЭHCOOCH3
C. ЦфСДНкЪЧCH3CH2COOCH3D. ЦфЕЅЬхЪЧCH2=CHCOOCH3
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЫЕЗЈДэЮѓЕФЪЧ
A.ЪГЮяжаЕФгЊбјЮяжЪжївЊАќРЈЃКЬЧРрЁЂгЭжЌЁЂЕААзжЪЁЂЮЌЩњЫиЁЂЮоЛњбЮКЭЫЎ
B.ШМЩеЯрЭЌЬхЛ§ЕФЙмЕРУКЦјЃЈжївЊГЩЗжCOКЭH2ЃЉКЭЬьШЛЦјЃЌЙмЕРУКЦјЯћКФбѕЦјЬхЛ§Дѓ
C.гЭжЌУЛгаЙЬЖЈЕФШлЗаЕуЃЌЪЧЪГЮяжаВњЩњФмСПзюИпЕФгЊбјЮяжЪ
D.Н№ЪєФЦКЭЬМЫсФЦШмвКЖМПЩвдгУРДЧјЗжввДМЁЂввЫсКЭБН
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПОнБЈЕРвЛаЉУїНКЦѓвЕНЋЦЄИяЗЯСЯАОжЦГЩЙЄвЕУїНКЃЌГіЪлИјФГаЉжЦвЉЦѓвЕЃЌзюжеБфГЩвЉгУНКФвЁЃгЩЙЄвЕУїНКжЦГЩЕФНКФвЭљЭљКЌгаГЌБъЕФжиН№ЪєИѕЃЌДгЖјЖдШЫЬхдьГЩЩЫКІЁЃУїНКЪЧЫЎШмадЕААзжЪЛьКЯЮяЃЌШмгкЫЎаЮГЩНКЬхЁЃ
(1)вбжЊFe(CrO2)2жаИѕдЊЫиЪЧ+3МлЃЌдђЦфжаЬњдЊЫиЪЧ________МлЁЃCrO2-ЪЧвЛжжЫсИљРызгЃЌдђFe(CrO2)2Ъєгк________(ЬюЁАЫсЁБЁАМюЁБЁАбЮЁБЛђЁАбѕЛЏЮяЁБ)ЁЃ
(2)УїНКЕФЫЎШмвККЭK2SO4ШмвКЙВЭЌОпБИЕФаджЪЪЧ________(ЬюађКХ)ЁЃ
aЃЎЖМВЛЮШЖЈЃЌУмЗтЗХжУВњЩњГСЕэ
bЃЎСНепОљгаЖЁДяЖћаЇгІ
cЃЎЗжЩЂжЪЮЂСЃПЩЭЈЙ§ТЫжН
(3)вбжЊНКЬхЕФЗжЩЂжЪВЛФмЭИЙ§АыЭИФЄЃЌЕЋЫЎЗжзгЕШаЁЗжзгЛђРызгФмЭИЙ§АыЭИФЄЁЃЬсДПУїНКЕФзАжУЪЧЯТСажаЕФ________(ЬюађКХ)ЁЃ
(4)Яжга10 mLУїНКЕФЫЎШмвКгы5 mL Na2SO4ШмвКЛьКЯзАШыАыЭИФЄФкЃЌНЋДЫАыЭИФЄНўШыЪЂеєСѓЫЎЕФЩеБжаЃЌЩшМЦЪЕбщжЄУїSO42-ФмЙЛЭИЙ§АыЭИФЄЃК__________________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЃКЂйAЕФВњСПЭЈГЃгУРДКтСПвЛИіЙњМвЕФЪЏгЭЛЏЙЄЫЎЦНЃЛЂк2CH3CHOЃЋO2![]() 2CH3COOHЁЃЯжвдAЮЊжївЊдСЯКЯГЩЛЏКЯЮяEЃЌЦфКЯГЩТЗЯпШчЭМ1ЫљЪОЁЃЛиД№ЯТСаЮЪЬтЃК
2CH3COOHЁЃЯжвдAЮЊжївЊдСЯКЯГЩЛЏКЯЮяEЃЌЦфКЯГЩТЗЯпШчЭМ1ЫљЪОЁЃЛиД№ЯТСаЮЪЬтЃК

ЃЈ1ЃЉаДГіЯТСаЮяжЪЕФЙйФмЭХУћГЦЃКBЃК____________________ЃЛDЃК____________________ЁЃ
ЃЈ2ЃЉЗДгІЂмЕФЛЏбЇЗНГЬЪНЮЊ________________________________________________ЃЌЗДгІРраЭЃК________ЁЃ
ЃЈ3ЃЉФГбЇЯАаЁзщЩшМЦЮяжЪBДпЛЏбѕЛЏЕФЪЕбщзАжУШчЯТЃЌИљОнЭМ2зАжУЛиД№ЮЪЬтЁЃ

ЂйзАжУМззЖаЮЦПжаЪЂЗХЕФЙЬЬхвЉЦЗПЩФмЮЊ________(ЬюзжФИ)ЁЃ
AЃЎNa2O2 BЃЎKClCЃЎNa2CO3 DЃЎMnO2
ЂкЪЕбщЙ§ГЬжаЃЌБћзАжУгВжЪВЃСЇЙмжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_______________________________ЁЃ
ЂлЮяжЪBЕФДпЛЏбѕЛЏВњЮягыЦЯЬбЬЧОпгаЯрЭЌЕФЬиеїЗДгІЃЌНЋЫљЕУЕФбѕЛЏВњЮяЕЮМгЕНаТжЦЧтбѕЛЏЭаќзЧвКжаМгШШЃЌЯжЯѓЮЊ______________________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГбаОПадбЇЯАаЁзщРћгУЯТЭМзАжУЬНОПВнЫсбЧЬњОЇЬх(FeC2O4ЁЄ2H2O)ЕФЗжНтВњЮяЃЌЯТСаЫЕЗЈДэЮѓЕФЪЧ
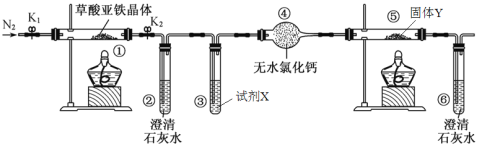
A. ЪЕбщЧАЭЈШыN2ЕФзїгУЪЧХХГізАжУФкЕФПеЦј
B. ЂкЁЂЂожаГЮЧхЪЏЛвЫЎЕФзїгУОљЪЧЮЊСЫМьбщCO2ЦјЬх
C. зАжУжаЪдМСXЮЊNaOHШмвКЃЌЙЬЬхYЮЊCuOЙЬЬх
D. НЋЂйжаЫљЕУЙЬЬхШмгкKSCNШмвКЃЌПЩвдМьбщЦфжаЬњдЊЫиЕФЛЏКЯМл
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁППЦбЇМвПЊЗЂГіСЫЖржжЬЋбєФмЕчГиЃЌГ§ОЇЬхЙшЬЋбєФмЕчГиЭтЃЌЛЙгаGaAsЬЋбєФмЕчГиЁЂЭюїяиЮјБЁФЄЬЋбєФмЕчГиЕШЁЃ
(1)ЛљЬЌGaдзгЕФЕчзгХХВМЪНЮЊ________ЁЃ
(2)ИпЮТЯТCuOШнвззЊЛЏЮЊCu2OЃЌЪдДгдзгНсЙЙНЧЖШНтЪЭдвђ________________ЁЃ
(3)H2SeЗжзгЕФМќНЧ_______H2OЗжзгЕФМќНЧ(бЁЬюЁА>ЁБЁЂЁА=ЁБЛђЁА<ЁБ)ЁЃаДГігыSeO3ЛЅЮЊЕШЕчзгЬхЕФвЛжжвѕРызг_____________(аДЛЏбЇЪН)ЁЃ
(4) AsF3ЗжзгЕФСЂЬхЙЙаЭЮЊ__________ЃЛAsF3ЪЧМЋадЗжзгЃЌРэгЩЪЧ_________________ЁЃ
(5)Ga(OH)3гыNaOHШмвКЗДгІЩњГЩNa[Ga(OH)4]ЁЃNa[Ga(OH)4]ШмвКжаКЌгаЕФЛЏбЇМќга__________________ЁЃ
A.ЙВМлМќ B.РызгМќ C.Н№ЪєМќ D.ХфЮЛМќ E.ЧтМќ
(6)Н№ИеЩА(SiC)ОЇАћШчЭМЫљЪОЃК
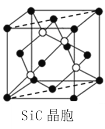
Н№ИеЩАжаЙшдзгЕФдгЛЏЙьЕРРраЭЮЊ_______ЃЌбиОЇАћЭМжаащЯпЗНЯђЕФЧаУцЭМЮЊ__________(ЬюБъКХ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаШШЛЏбЇЗНГЬЪНжаЃЌе§ШЗЕФЪЧЃЈ ЃЉ
A.МзЭщШМЩеШШЮЊ890.3 kJmol-1ЃЌШШЛЏбЇЗНГЬЪНЮЊЃКCH4(g)+2O2(g)=CO2(g)+2H2O(g) ЁїH=+890.3 kJmolЁЅ1
B.ЯЁбЮЫсКЭЯЁЧтбѕЛЏФЦШмвКЛьКЯЃЌЦфШШЛЏбЇЗНГЬЪНЮЊЃКH++OH-=H2O ЁїH=-57.3 kJmolЁЅ1
C.H2ШМЩеШШЮЊ285.8kJmolЁЅ1ЃЌШМЩеЕФШШЛЏбЇЗНГЬЪНЮЊЃК2H2(g)+O2(g)=2H2O(1) ЁїH=-571.6 kJmolЁЅ1
D.500ЁцЁЂ30 MPaЯТЃЌНЋ0.5 mol N2КЭ1.5 mol H2жУгкУмБеЕФШнЦїжаГфЗжЗДгІЩњГЩNH3(g)ЃЌЗХШШ19.3 kJЃЌЦфШШЛЏбЇЗНГЬЪНЮЊЃКN2(g)+3H2(g)![]() 2NH3(g) ЁїH=-38.6 kJЁЄmol-1
2NH3(g) ЁїH=-38.6 kJЁЄmol-1
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com