
【题目】以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+等)为原料制备氧化锌的流程如下:
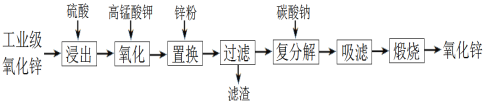
其中“氧化”加入KMnO4是为了除去浸出液中的Fe2+和Mn2+。下列有关说法错误的是
A. 浸出时通过粉碎氧化锌提高了浸出率
B. “氧化”生成的固体是MnO2和Fe(OH)3
C. “置换”加入锌粉是为了除去溶液中的Cu2+、Ni2+等
D. “煅烧”操作用到的仪器:玻璃棒、蒸发皿、泥三角
【答案】D
【解析】
A.浸出时通过粉碎固体氧化锌,使物质颗粒变小,扩大了与硫酸的接触面积,反应速率加快,因而也可以提高了浸出率,A正确;
B.向硫酸浸取工业级ZnO后的溶液中存在Fe2+、Mn2+、Zn2+和Ni2+,加入KMnO4溶液,Ni2+不能被氧化,Fe2+、Mn2+被氧化而形成MnO2和Fe(OH)3除去,KMnO4被还原形成MnO2,B正确;
C.由于金属活动性Zn>Ni>Cu,所以“置换”加入锌粉可以与溶液中的是为了与溶液中Ni2+、Cu2+发生主反应,除去溶液中的Cu2+、Ni2+等,C正确;
D. “煅烧”操作用到的仪器:玻璃棒、坩埚、泥三角,D错误;
故合理选项是D。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,回答下列问题:
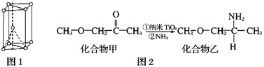
(1)金属钛晶胞如图1所示,为___________堆积(填堆积方式)。
(2)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图2。化合物乙的沸点明显高于化合物甲,主要原因是________________。
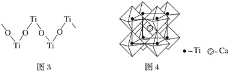
(3)硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图3所示,其化学式为_______________。
(4)钙钛矿晶体的结构如图4所示。钛离子位于立方晶胞的顶角,被__________个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被__________个氧离子包围,钙钛矿晶体的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道一些明胶企业将皮革废料熬制成工业明胶,出售给某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,从而对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是________价。CrO2-是一种酸根离子,则Fe(CrO2)2属于________(填“酸”“碱”“盐”或“氧化物”)。
(2)明胶的水溶液和K2SO4溶液共同具备的性质是________(填序号)。
a.都不稳定,密封放置产生沉淀
b.两者均有丁达尔效应
c.分散质微粒可通过滤纸
(3)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的装置是下列中的________(填序号)。
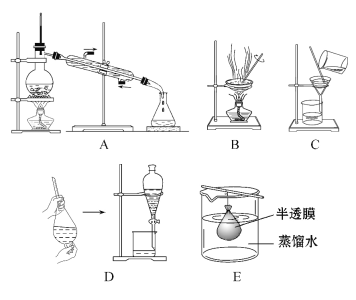
(4)现有10 mL明胶的水溶液与5 mL Na2SO4溶液混合装入半透膜内,将此半透膜浸入盛蒸馏水的烧杯中,设计实验证明SO42-能够透过半透膜:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用下图装置探究草酸亚铁晶体(FeC2O4·2H2O)的分解产物,下列说法错误的是
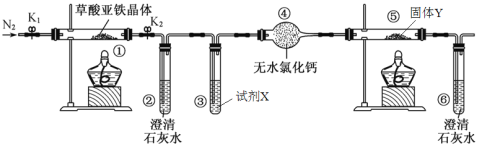
A. 实验前通入N2的作用是排出装置内的空气
B. ②、⑥中澄清石灰水的作用均是为了检验CO2气体
C. 装置中试剂X为NaOH溶液,固体Y为CuO固体
D. 将①中所得固体溶于KSCN溶液,可以检验其中铁元素的化合价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的有
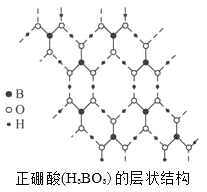
A. 在H3BO3分子中各原子最外层全部满足8电子稳定结构
B. H3BO3分子的稳定性与氢键有关
C. 1mol H3BO3的晶体中有3mol极性共价键
D. 1mol H3BO3的晶体中有3mol氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家开发出了多种太阳能电池,除晶体硅太阳能电池外,还有GaAs太阳能电池、铜铟镓硒薄膜太阳能电池等。
(1)基态Ga原子的电子排布式为________。
(2)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因________________。
(3)H2Se分子的键角_______H2O分子的键角(选填“>”、“=”或“<”)。写出与SeO3互为等电子体的一种阴离子_____________(写化学式)。
(4) AsF3分子的立体构型为__________;AsF3是极性分子,理由是_________________。
(5)Ga(OH)3与NaOH溶液反应生成Na[Ga(OH)4]。Na[Ga(OH)4]溶液中含有的化学键有__________________。
A.共价键 B.离子键 C.金属键 D.配位键 E.氢键
(6)金刚砂(SiC)晶胞如图所示:
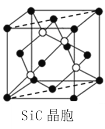
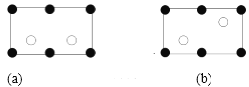
金刚砂中硅原子的杂化轨道类型为_______,沿晶胞图中虚线方向的切面图为__________(填标号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2可用作食品添加剂。NaNO2能发生以下反应:3NO2-+2H+=NO3-+2NO↑+H2O
NO2-+Ag+=AgNO2↓(淡黄色)
某化学兴趣小组进行以下探究。回答有关问题:
(l)制取NaNO2反应原理:Na2CO3+2NO2=NaNO2+NaNO3+CO2 Na2CO3+NO+NO2=2NaNO2+CO2
用下图所示装置进行实验。
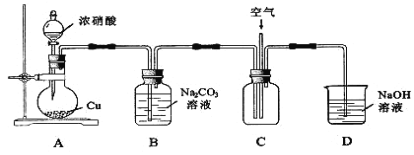
①铜与浓硝酸反应的化学方程式为______________________________。
②实验过程中,需控制B中溶液的pH>7,否则产率会下降,理由是_________。
③往C中通入空气的目的是____________________(用化学方程式表示)。
④反应结束后,B中溶液经蒸发浓缩、冷却结品、___________ 等操作,可得到粗产品晶体和母液。
(2)测定粗产品中NaNO2的含量
称取5.000g粗产品,溶解后稀释至250mL。取出25.00 mL溶液,用0.1000 mol·L-1KMNO4酸性溶液平行滴定三次,平均消耗的体积为20.00mL。已知:2MnO4-+6H++5NO2-=5NO3-+2Mn2++3H2O
①稀释溶液时,需使用的玻璃仪器除烧杯、玻璃棒外,还有 _________(填标号)。
A.容量瓶 B.量筒 C.胶头滴管 D.锥形瓶
②当观察到_________________时,滴定达到终点。
③粗产品中NaNO2的质量分数为____________ (用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiHCl3在催化剂作用下主要发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g) ΔH=+48kJ·mol-1。已知:反应速率
SiH2Cl2(g)+SiCl4(g) ΔH=+48kJ·mol-1。已知:反应速率![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。

下列说法正确的是( )
A.343K时反应物的平衡转化率为21%
B.a点的反应速率小于b点的反应速率
C.343K时![]() =
=![]()
D.由323K的平衡转化率数据,不能计算323K的平衡常数K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol有机物X最多能与1 mol HCl发生加成反应得到Y,1 mol Y能与4 mol Cl2在一定条件下发生取代反应得到Z。已知Y分子中的碳碳键都是单键,Z分子中没有氢原子,则X的结构简式可能是( )
A.![]() B.CH≡CH
B.CH≡CH
C.![]() D.CH≡CCH3
D.CH≡CCH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com