
【题目】两种不同浓度的NaOH溶液,c(H+)分别为1×10-14 mol/L 和1×10-10 mol/L。将此两溶液等体积混合后,所得溶液中的c(H+)是( )
A.1×(10-14+10-10) mol/LB.![]() mol/L
mol/L
C.2×10-10 mol/LD.2×10-14 mol/L
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】某有机物的结构为如图所示,关于这种有机物不正确的说法有
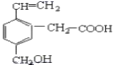
①该物质分子式为C11H12O3,能溶于水;
②能使溴水、酸性KMnO4溶液褪色,且原理相同;
③分别与Na、NaHCO3反应两者生成气体的物质的量之比均是1:1;
④能发生取代、加成、水解、氧化、还原反应
A.1种B.2种C.3种D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随新能源汽车的发展,新能源电池技术也在不断创新,典型的锂离子电池一般以LiCoO2或LiFePO4等为正极材料,以石墨碳为负极材料,以溶有LiPF6等的有机溶液为电解质溶液。
(1)P原子的电子排布式为_________。Fe2+中未成对电子数为___________。
(2)N、O、F原子的第一电离能由小到大的顺序为_______。
(3)等电子体具有相似的化学键特征,它们的许多性质是相近的。ClO4-与PO43-互为等电子体,ClO4-的立体构型为_______,中心原子的杂化轨道类型为________。
(4)烷烃同系物中,CH4的沸点最低,原因是______________。
(5)向CuSO4溶液中加入氨水,首先形成蓝色沉淀,继续加氨水,沉淀溶解,得到深蓝色溶液,在此溶液中加入乙醇,析出深蓝色的晶体。由蓝色沉淀得到深蓝色溶液的离子方程式为_______________;深蓝色晶体中存在的化学键类型有__________ 。(填代号)
A.离子键
B.σ键
C.非极性共价键
D.配位键
E.金属键
F.氢键
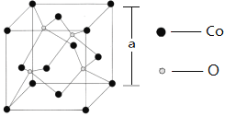
(6)如图所示为Co的某种氧化物的晶胞结构图,则该氧化物的化学式为______;若该晶胞的棱长为a pm,则该晶体的密度为_____________g/cm3。(NA为阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BHT是一种常用的食品抗氧化剂,从![]() 出发合成BHT的方法有如下两种。下列说法不正确的是( )
出发合成BHT的方法有如下两种。下列说法不正确的是( )

A. 方法一和方法二的反应类型都是加成反应
B. BHT与![]() 都能使酸性KMnO4溶液褪色
都能使酸性KMnO4溶液褪色
C. 推测BHT在水中的溶解度小于苯酚
D. BHT与![]() 互为同系物
互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气的脱硫脱硝是目前研究的热点。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJmol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJmol-1
③H2O(g)=H2O(l) △H=-44 kJmol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l) 的热化学方程式_________。
(2)某科研小组研究臭氧氧化--碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+ O3(g) NO2(g)+O2(g) △H1= -200.9 kJmol-1Ea1= 3.2 kJmol-1
反应Ⅱ:SO2(g)+ O3(g) SO3(g)+O2(g)△H2= -241.6 kJmol-1 Ea2= 58 kJmol-1
已知该体系中臭氧发生分解反应:2O3(g) 3O2(g)。请回答:
其它条件不变,每次向容积为2L的反应器中充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:
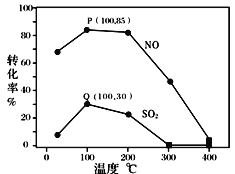
①由图可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______。
②下列说法正确的是 ____________ 。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
③假设100℃时P(NO转化率为85%)、Q(SO2转化率为30%)均为平衡点,此时反应时间为10分钟,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是_______mol;NO的平均反应速率为_______________;反应Ⅱ在此时的平衡常数为_______________ 。
(3)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:
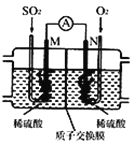
①M极发生的电极反应式为 ____________。
②当外电路通过0.2 mol电子时,质子交换膜左侧的溶液质量_____(填“增大”或“减小”)_______克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N、P、Ti等元素组成的新型材料有着广泛的用途,请回答下列问题。
(1)钛元素基态原子未成对电子数为____个,能量最高的电子占据的能级符号为__。
(2)磷的一种同素异形体—白磷(P4)的立体构型为____,推测其在CS2中的溶解度____(填“大于”或“小于”)在水中的溶解度。
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因:________。
(4)工业上制金属钛采用金属还原四氯化钛。先将TiO2(或天然的金红石)和足量炭粉混合加热至1000~1100K,进行氯化处理,生成TiCl4。写出生成TiCl4的化学反应方程式:______。
(5)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为____,已知晶体的密度为pg·cm-3,阿伏加德罗常数为NA,则晶胞边长为____cm(用含p、NA的式子表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂的某些化合物是性能优异的材料。请回答:
(1)如图是某电动汽车电池正极材料的晶胞结构示意图,其化学式为 ______ ,其中![]() 的基态电子排布式为 ______ ,
的基态电子排布式为 ______ ,![]() 的空间构型为 ______ 。
的空间构型为 ______ 。
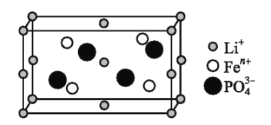
(2)![]() 与Na中第一电离能较小的元素是 ______ ;LiF与NaCl晶体中熔点较高的是 ______ 。
与Na中第一电离能较小的元素是 ______ ;LiF与NaCl晶体中熔点较高的是 ______ 。
(3)氮化锂是一种良好的储氢材料,其在氢气中加热时可吸收氢气得到氨基锂![]() 和氢化锂,氢化锂的电子式为 ______ ,上述反应的化学方程式为 ______。
和氢化锂,氢化锂的电子式为 ______ ,上述反应的化学方程式为 ______。
(4)金属锂为体心立方晶胞,其配位数为 ______ ;若其晶胞边长为apm,则锂晶体中原子的空间占有率是 ______ 。
(5)有机锂试剂在有机合成中有重要应用,但极易与![]() 、
、![]() 等反应.下列说法不正确的是 ______
等反应.下列说法不正确的是 ______ ![]() 填字母序号
填字母序号![]() 。
。
A.CO2中σ键与π键的数目比为1:1
B.游离态和化合态锂元素均可由特征发射光谱检出
C.叔丁基锂(C4H9Li)中碳原子的杂化轨道类型为sp3和sp2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲探究FeSO4溶液与浓HNO3的反应。
该同学向盛有FeSO4溶液的试管中滴入数滴浓硝酸,并振荡试管,预期现象为试管中会立即产生红棕色气体,溶液焰色逐渐变黄。但实际操作时观察到液面上方气体变化红棕色,且试管中溶液颜色变为深棕色。
为了进一步探究溶液变为深棕色的原因,该同学进行如下实验。
回答下列问题
(1)向FeSO4溶液和反应后溶液中加入KSCN溶液,前者不变红色,后者变红,该现象的结论是________。
(2)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的。为此他利用如图装置(气密性已检验,尾气处理装备略)进行探究。
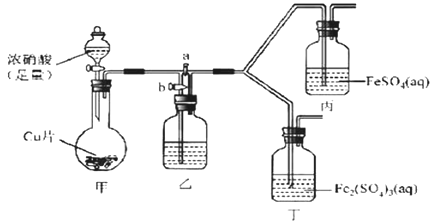
Ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化。
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应。
Ⅲ.为与Ⅰ中实验进行对照重新更换丙、丁后,使甲中反应重复进行步骤Ⅰ实验,观察到的现象与步骤Ⅰ中相同。
①铜与足量浓硝酸反应的离子方程式是_______________。
②装置乙的试剂为____________________。
③步骤Ⅱ的目的是_______________________。
④该实验可得出的结论是______________________。
(3)该同学重新进行FeSO4溶液与浓HNO3的反应的实验,观察到了预期现象,其实验操作是_________,反应的离子方程式为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在等温等容条件下,有下列气体反应:2A(g)+2B(g)![]() C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ:A、B的起始浓度均为2mol/L。Ⅱ:C、D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是( )
C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ:A、B的起始浓度均为2mol/L。Ⅱ:C、D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是( )
A.Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的平均相对分子质量不同
B.Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的百分组成不同
C.达到平衡时Ⅰ途径的VA等于Ⅱ途径的VA
D.达到平衡后,第Ⅰ途径混合气密度为第Ⅱ途径混合气密度的![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com