
| 实验操作 | 实验现象 | 实验结论 |
| 用玻璃片将水槽中的试管口盖住,轻轻将试管取出 | 试管内约有2/3体积的水溶液,且无色 | NO2与水发生了化学反应,而不是溶于水 |
| 将试管正立,取下玻璃片 | 甲 | NO2和水反应生成了NO气体 |
| 乙 | 丙 | NO2和水反应生成了硝酸 |
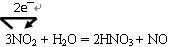 ................3分,方程式、电子转移方向及数目各1分
................3分,方程式、电子转移方向及数目各1分

科目:高中化学 来源:不详 题型:实验题
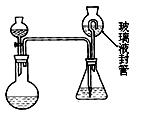
 某合作学习小组的同学拟证实其中的有效成分并测定二氧化氯的含量(用样品和酸反应产生二氧化氯的质量与样品质量的比值来衡量)。请回答下列问题:
某合作学习小组的同学拟证实其中的有效成分并测定二氧化氯的含量(用样品和酸反应产生二氧化氯的质量与样品质量的比值来衡量)。请回答下列问题: (1)为证实“稳定性二氧化氯溶液”中含有钠离子,其正确的操作步骤是: 。
(1)为证实“稳定性二氧化氯溶液”中含有钠离子,其正确的操作步骤是: 。 (2)为测定“稳定性二氧化氯溶液”中二氧化氯的含量,现进行以下操作:①取mg(2g左右)
(2)为测定“稳定性二氧化氯溶液”中二氧化氯的含量,现进行以下操作:①取mg(2g左右) 试样,置于烧瓶中,向分液漏斗中加入10mL盐酸溶液;②在锥形瓶中加入4g碘化钾,用100mL水溶解后,再加3mL硫酸溶液;③在玻璃液封管中加入水;④将分液漏斗中的盐酸溶液放入烧瓶中,关闭旋塞。缓慢加热烧瓶,使产生的二氧化氯气体全部通过导管在锥形瓶中被吸收;⑤将玻璃液封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定至蓝色消失(I2+2S2O32-=2I- +S4O62-),共用去VmL硫代硫酸钠溶液。
试样,置于烧瓶中,向分液漏斗中加入10mL盐酸溶液;②在锥形瓶中加入4g碘化钾,用100mL水溶解后,再加3mL硫酸溶液;③在玻璃液封管中加入水;④将分液漏斗中的盐酸溶液放入烧瓶中,关闭旋塞。缓慢加热烧瓶,使产生的二氧化氯气体全部通过导管在锥形瓶中被吸收;⑤将玻璃液封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定至蓝色消失(I2+2S2O32-=2I- +S4O62-),共用去VmL硫代硫酸钠溶液。 方程式为:
方程式为: 二氧化氯被还原为氯离子,该反应的离子方程式为: 。
二氧化氯被还原为氯离子,该反应的离子方程式为: 。 (Ⅱ)装置中玻璃液封管的作用是: ;如何确定烧瓶中
(Ⅱ)装置中玻璃液封管的作用是: ;如何确定烧瓶中 的二氧化氯全部被锥形瓶中的液体吸收 。
的二氧化氯全部被锥形瓶中的液体吸收 。 (Ⅲ)“稳定性二氧化氯溶液”中,ClO2的质量分数为
(Ⅲ)“稳定性二氧化氯溶液”中,ClO2的质量分数为  (用m、c、V表示)。
(用m、c、V表示)。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验操作 | 预期现象与结论 |
| 步骤1:取一定量 B 于试管中,然后边震荡试管边慢慢加入适量 C 和 D 。 | |
| 步骤2:固定好装置,用酒精灯缓慢加热。将产生的蒸气通到 E 溶液的液面上。 | F , G 。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
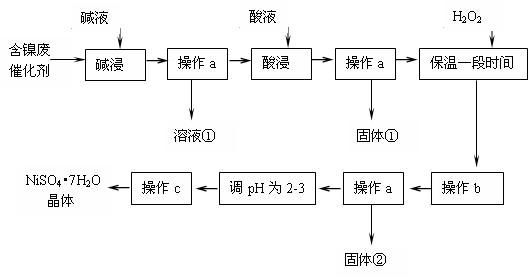
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
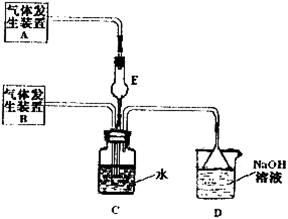
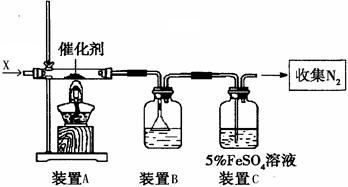
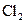 、
、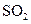 气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸为原料制取C12。在此实验中,E仪器的作用是__________;发生装置B应选择以下三种装置中的___________(填序号)。
气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸为原料制取C12。在此实验中,E仪器的作用是__________;发生装置B应选择以下三种装置中的___________(填序号)。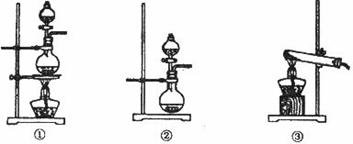
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 入一种固体试剂,该试剂的名称为_________,B中能产生氨气和氧气混合气体的原
入一种固体试剂,该试剂的名称为_________,B中能产生氨气和氧气混合气体的原 因(结合化学方程式回答)_ __。
因(结合化学方程式回答)_ __。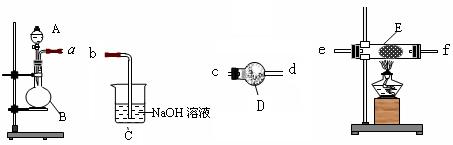
 4NO2(g);△H>0,下表为反应在某温度下的部分实验数据:
4NO2(g);△H>0,下表为反应在某温度下的部分实验数据:| t/s | 0 | 500 | 1000 |
| c(N2O3)/mol·L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2 L溶液中Ba2+和Cl-的总数为0.8NA? |
| B.500 mL溶液中Cl-的浓度为0.2 mol·L-1 |
| C.500 mL溶液中Ba2+的浓度为0.2 mol·L-1 |
| D.500 mL溶液中Cl-的总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 假设2:既不存在SO32-也不存在ClO-
假设2:既不存在SO32-也不存在ClO- ______
______ L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.| 实验步骤 | 预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 moL L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 |  |
| 步骤2: | |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
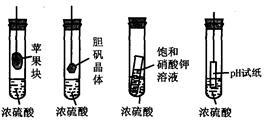
| A.苹果块会干瘪 | B.胆矾晶体表面有“白斑” |
| C.小试管内有晶体析出 | D.pH试纸变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com