
对于平衡CO2(g)  CO2(aq) △H <0,为增大CO2在水中的溶解度,应采用的方法是
CO2(aq) △H <0,为增大CO2在水中的溶解度,应采用的方法是
A.增加压强 B.升高温度 C.不断搅拌 D.升温减压
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:2015-2016学年江苏省华士、成化、山观三校高一上期中联考化学试卷(解析版) 题型:实验题
实验室需配制950mL 0.1mol/L的Na2CO3溶液,填空并请回答下列问题:
(1)配制时应选用的容量瓶的规格为 ,用托盘天平称取Na2CO3的质量为 g ;
(2)配制时,其正确的操作顺序是(用字母填空,每个字母只能用一次) ;
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用托盘天平准确称取所需的Na2CO3的质量,放入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其完全溶解
C.将已冷却的Na2CO3溶液沿玻璃棒注入一定规格的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)若出现如下情况,所配溶液浓度偏高的有
①容量瓶中原来存有少量蒸馏水;
②溶解后未洗涤烧杯和玻璃棒;
③定容时加水超过了刻度线,用胶头滴管吸出一些溶液使液面达到刻度线;
④搅拌或转移溶液时有液体溅出;
⑤给容量瓶定容时,俯视读数;
⑥称取固体时,药品与砝码的位置放反。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏银川第九中学高二上学期期中测试化学试卷(解析版) 题型:选择题
在2A+B  3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.v(A)=0.5 mol·L-1·s-1
B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1
D.v(D)=1.6 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期期中阶段测试化学试卷(解析版) 题型:选择题
下列事实所对应的方程式不正确的是(反应条件已略去)
A.盛放氢氧化钠溶液的试剂瓶不能用玻璃塞:SiO2 + 2NaOH = Na2SiO3 + H2O
B.高温下铁与水蒸气反应生成保护膜:2Fe + 6H2O(g) = 2Fe(OH)3 + 3H2↑
C.工业制取漂粉精:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
D.实验室制取氨气:2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑+ 2H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省宣城、郎溪、广德三校高二上期中联考化学试卷(解析版) 题型:填空题
下表中的数据是破坏1 mol物质的化学键所消耗的能量:
物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
根据上述数据回答:
(1) 下列氢化物中,最不稳定的是
A.HCl B.HBr C.HI
(2)H2和Cl2反应生成HCl过程中的热效应可用下图表示,请回答下列问题:

①ΔH1= kJ·mol-1,ΔH2= kJ·mol-1,ΔH3= kJ·mol-1。
②据实验测定,H2和Cl2的混合气体在光照下反应生成HCl,引发该反应的步骤是上图①~③中分子转化为原子的一步,你认为是第 (填序号)步,请说明原因: 。
③该反应的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(解析版) 题型:填空题
空气中CO2的含量及有效利用,已经引起各国的普遍重视
Ⅰ: 目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示。
CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示。
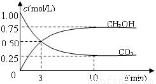
(1)前3min内,平均反应速率v(H2)= mol·L-1·min-1。此温度下该反应的平衡常数为 (保留两位小数,注意要写单位)。
(2)下列措施中,既能使反应加快,又能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入惰性气体
C.将H2O(g)从体系中分离 D.再充入1mol H2
(3)图乙中t5时引起平衡移动的条件是 。(填序号)
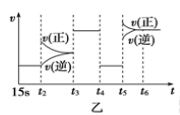
A.升高温度 B.增大反应物浓度 C.使用催化剂 D.增大体系压强
(4)反应达到平衡后,若向反应体系再加入CO2(g)、H2(g) 、CH3OH(g)、H2O(g)各1mol,化学平衡 (填“正向”、“逆向”或“不”)移动。
Ⅱ:利用CO2(g)+CH4(g) 2CO(g)+2H2(g)将CO2转化成燃料气。T℃时,在恒容密闭容器中通入物质的量均为0.1 mol的CH4与CO2,发生上述反应,吸收热量Q1kJ,测得CH4的平衡转化率与温度及压强的关系如图所示
2CO(g)+2H2(g)将CO2转化成燃料气。T℃时,在恒容密闭容器中通入物质的量均为0.1 mol的CH4与CO2,发生上述反应,吸收热量Q1kJ,测得CH4的平衡转化率与温度及压强的关系如图所示
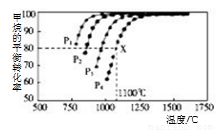
(5)下列事实能说明该反应达到平衡的是( )
a.CO的物质的量不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO2)= 2v逆(H2)
d.混合气体压强不再发生变化
e.单位时间内生成n mol CH4的同时消耗2n mol H2
(6)据图可知P1、P2、P3、P4由小到大的顺序是 。
(7)若将上述容器改为恒压容器(反应前体积相同),起始时通入物质的量均为0.1 mol的CH4与CO2,相同的温度下充分反应达到平衡后,放出热量Q2 kJ,
则Q1 Q2(填 “>”“=”或“<”)
Ⅲ: 设反应①Fe(s)+CO2(g) FeO(s)+CO(g) 和反应②Fe(s)+H2O(g)
FeO(s)+CO(g) 和反应②Fe(s)+H2O(g) FeO(s)+H2(g)的平衡常数分别为K1、K2,在不同温度下, K1、K2的值如下表所示:
FeO(s)+H2(g)的平衡常数分别为K1、K2,在不同温度下, K1、K2的值如下表所示:
T(K) | K1 | K2 |
973 | 1.47 | 2.36 |
1173 | 2.15 | 1.67 |
(8)现有反应CO2(g)+H2(g) CO(g)+H2O(g),是 (填“吸”或“放”)热反应。
CO(g)+H2O(g),是 (填“吸”或“放”)热反应。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(解析版) 题型:选择题
如图所示,利用2Ag + Cl2 = 2AgCl设计的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质)。下列分析不正确的是

A.空气中c(Cl2)越大,Ag极消耗速率越快
B.Ag+向Pt电极移动
C.电子由Ag电极经外电路流向Pt电极
D.Ag电极上发生了还原反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高一上学期期中测试化学试卷(解析版) 题型:选择题
24mL浓度为0.05mol/L 的Na2SO3溶液恰好与20mL浓度为0.02 mol/L的K2Cr2O7溶液完全反应;已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为
A、+2 B、+3 C、+4 D、+5
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上期中联考化学试卷(解析版) 题型:选择题
将20mL 0.4mol/L硝酸铵溶液跟50mL 0.1mol/L 氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是
A.c(NO3-)>c(OH-)>c(NH4+)>c(Ba2+)
B.c (NO3-)>c(Ba2+)>c(OH-)>c(NH4+)
C.c(Ba2+)>c(NO3-)>c(OH-)>c(NH4+)
D.c(NO3-)>c(Ba2+)>c(NH4+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com