
下列有关分子中指定原子的杂化类型正确的是
A.CH4分子中C原子:sp B.BF3中B原子:sp3
C.C2H2中C原子:sp D.SiO2中Si原子:sp2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)  Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
A.混合气体的密度不再变化
B.反应容器中Y的质量分数不变
C.X的分解速率与Y的消耗速率相等
D.单位时间内生成1 mol Y的同时生成2 mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
南京将于2014年承办世界青奥会。下列措施不利于节能减排、改善环境质量的是
( )
A.利用太阳能等清洁能源代替化石燃料
B.引进电动汽车,减少汽车尾气排放
C.积极推行和使用能被微生物降解的新型聚合物材料
D.使用填埋法处理未经分类的生活垃圾
查看答案和解析>>
科目:高中化学 来源: 题型:
中科院国家纳米科学中心2013年11月22日宣布,该中心科研人员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。这不仅将人类对微观世界的认识向前推进了一大步,也为在分子、原子尺度上的研究提供了更精确的方法。下列说法中正确的是
A.正是氢键的存在,冰能浮在水面上
B.氢键是自然界中最重要、存在最广泛的化学键之一
C.由于氢键的存在,沸点:HCl>HBr>HI>HF
D.由于氢键的存在,水分子变的更稳定了
查看答案和解析>>
科目:高中化学 来源: 题型:
某金属晶体M有两种堆积形式,如下图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同。

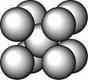
甲 乙
(1)乙的堆积方式称为 堆积;
甲和乙两种堆积方式中配位数之比为 ,
晶胞边长之比为 。
(2)在T℃以下测定该金属晶体有关性质参数如下表所示。已知原子化热指1mol金属由固态转变为气态原子时所需要吸收的热量,是衡量金属键强弱的物理量。
| 金属 | 相对原子质量 | 密度/g·㎝-3 | 原子化热/kJ·mol-1 |
| Na | 22. 99 | 0. 960 | 108. 4 |
| M | 60. 20 | 7. 407 | 7735 |
预测该金属的熔点比Na (填“高”或“低”),由上述数据可计算M原子的原子半径为 pm。
(已知 ,7. 407≈
,7. 407≈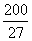 ,1pm=10
,1pm=10 m)
m)
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨的反应为:3H2 + N2 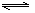 2NH3,其反应的速率可分别表示为v(H2)、v(N2)、v(NH3)(单位为mol·L-1·s-1),则下列关系正确的是 ( )
2NH3,其反应的速率可分别表示为v(H2)、v(N2)、v(NH3)(单位为mol·L-1·s-1),则下列关系正确的是 ( )
A、v(H2)=v(N2)= v(NH3) B、v(H2)=3 v(N2)
C、v(N2)=2 v(NH3) D、v(NH3)=3/2v(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为
(2)从开始至2min,Z的平均反应速率为

查看答案和解析>>
科目:高中化学 来源: 题型:
某一元弱酸(用HA表示)在水中的电离方程式是:HA H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向___________________________________
(填“正”或“逆”)反应方向移动,理由是_______________________________________。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向____________(填“正”或“逆”)反应方向移动,溶液中c(A-)将________(填“增大”“减小”或“不变”),溶液中c(OH-)将________(填“增大”“减小”或“不变”)。
(3)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH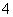 )=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________________。
)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com