
【题目】下列物质属于盐的是
A. NaOH B. H2SO4 C. Na2CO3 D. Cl2
科目:高中化学 来源: 题型:
【题目】下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是①金属钠在纯氧中的燃烧产物,②在FeSO4溶液中滴入NaOH溶液并在空气中放置一段时间,③向FeCl3溶液中滴入KSCN溶液,④无水硫酸铜溶解于水.( )
A. ③②①④ B. ②③①④ C. ③①②④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中含有H+、Ba2+、Al3+、NH4+、Fe3+、Fe2+、CO32-、SO32-、Cl-、SO42-、NO3-中的几种(除此以外,无其他大量存在的离子),针对该溶液进行实验,内容如下:
①用洁净的玻璃棒蘸取少量X溶液,点在PH 试纸上,试纸呈红色;
②取适量X溶液,加入过量的Ba(NO3)2溶液,得澄清透明的溶液A,并放出一种无色无味的气体B,在瓶口又慢慢变为红棕色
③向溶液A 中加入过量的NaOH 溶液,微热,放出一种刺激性气味的气体C,同时产生红褐色沉淀D,过滤得溶液F;
④向F溶液中通入过量的CO2,有白色沉淀G生成。请回答:
(1)G的化学式为:___________________________。
(2)检验气体C的方法_____________________;
(3)步骤②中反应的离子方程式为:_________________________;
(4)步骤3③中反应的离子方程式为:_______________________________;
(5)X溶液中一定含有的离子是_______________________________;在不能确定是否含有的离子中,若要确定其中一种,补做的实验是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将装有60mLNO2、NO混合气的量筒倒立于水槽中,反应后气体体积缩小为40mL,则混合气体中NO2和NO的体积比是( )
A.5:3
B.2:3
C.1:1
D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种来自石油的重要的有机化工原料,是衡量一个国家石油化工生产水平的标志;E是一种具有果香味的有机物,F是一种高聚物,可制成多种包装材料。(过程中的水或其他物质已省略)

(1)写出反应①的化学方程式_________________________________;反应类型____________;
(2)写出反应B+D→E的化学方程式___________________________反应类型___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究PM 2.5、SO2、NOx等,对监测空气质量具有重要意义.取某样本用蒸馏水处理制成待测液,其中所含离子的化学组分及其浓度如下表:
离子 | K+ | Na+ | NH4+ | H+ | SO42﹣ | NO3﹣ | Cl﹣ |
浓度/molL﹣1 | 4×10﹣6 | 6×10﹣6 | 2×10﹣5 | a | 4×10﹣5 | 3×10﹣5 | 2×10﹣5 |
请回答下列问题:
(1)根据表中数据计算此待测液中c(H+)浓度a为 mol/L.
(2)NOx是汽车尾气中的主要污染物之一.
①汽车发动机工作时的高温会引发N2和O2反应,反应的化学方程式是 .
②NOx能形成酸雨,由NO2形成酸雨的主要反应是(写离子方程式).
(3)为减少SO2的排放,常采取的措施有:
①在燃煤中加入生石灰可以起到固硫的作用,SO2被吸收后转化成一种硫元素的最高价态的化合物,该物质的化学式是 .
②吸收烟气中的SO2 , 以下物质可作吸收剂的是(填序号);硫酸工业中的尾气SO2可以循环利用,写出SO2转化为SO3反应的化学方程式 .
a.NaOH b.H2SO4 c.NaHSO3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解,水解生成Sn02·H20)
的反应为Sn+2Cl2 ![]() SnCl4, Sn也可以与HC1反应生成SnCl2。已知:
SnCl4, Sn也可以与HC1反应生成SnCl2。已知:
物质 | 摩尔质量(g/mol) | 熔点(℃) | 沸点(℃) |
Sn | 119 | 231 | 2260 |
SnCl2 | 190 | 246 | 623 |
SnCl4 | 261 | -30 | 114 |
制备装置如图所示:
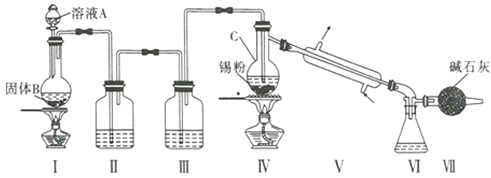
回答下列问题:
(1)Sn在元素周期表中的位罝为____________________________。
(2)II、III中的试剂分別为_______、__________;VII的作用是____________________、_____________。
(3)实验所得SnCl4因溶解了Cl2而略显黄色,提纯SnCl4的方法是____________(填序号)。
a.用NaOH溶液洗涤再蒸馏 b.升华 c.重结晶 d.蒸馏 e.过滤
(4)写出I中反应的化学方程式:_____________________________________。
(5)加热Sn粒之前要先让氯气充满整套装置,其目的是__________________________________。
(6)写出SnCl4水解的化学方程式:________________________________________。
(7)若IV中用去锡粉5.95g,反应后,VI中锥形瓶里收集到12.0gSnCl4,则SnCl4的产率为_____%。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液的叙述正确的是
A. pH=2的盐酸与pH=12的氨水等体积混合后所得溶液显中性
B. 等浓度等体积的强酸与强碱溶液混合后,溶液的pH=7
C. pH=10的Ba(OH)2溶液和pH=13的NaOH溶液等体积混合后溶液的pH=10.7(已知lg2=0.3)
D. 将l0 mL pH=a的盐酸与l00 mL pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com