
【题目】铬鞣剂[Cr(OH)SO4]可用于提高皮革的耐曲折强度。一种以铬渣(含Cr2O3及少量Fe2O3、CaO、Al2O3、SiO2等杂质)为原料制备Cr(OH)SO4的工艺流程如图:

回答下列问题:
(1)“焙烧”时发生的主要的化学方程式为__。
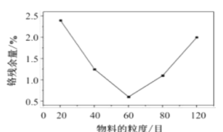
(2)“水浸”过程中,物料的粒度(颗粒大小)对铬残余量的影响如图所示,则最佳反应条件为__。
(3)“滤渣2”主要成分为Al(OH)3和__(填化学式),“过滤2”后,将溶液pH调至a(a小于6.5),发生的离子反应为__,若1L所得溶液中含铬元素的质量为28.6g,![]() 有
有![]() 转化为
转化为![]() 。酸化后所得溶液中c(
。酸化后所得溶液中c(![]() )=__。
)=__。
(4)根据有关国家标准,含![]() 的废水要经化学处理,使其浓度降至5.0×107mol·L1以下才能排放。含
的废水要经化学处理,使其浓度降至5.0×107mol·L1以下才能排放。含![]() 的废水处理通常可用沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×1010],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于__mol·L1,后续废水处理方能达到国家排放标准。
的废水处理通常可用沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×1010],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于__mol·L1,后续废水处理方能达到国家排放标准。
(5)已知CH3OH在酸性条件下可被氧化生成CO2,写出Na2Cr2O7与CH3OH反应生成Cr(OH)SO4的化学方程式__。
(6)某厂用m1kg的铬渣(含Cr2O340%)制备Cr(OH)SO4,最终得到产品m2kg,则产率为__。
【答案】2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2 物质的粒度为60目 H2SiO3 2
4Na2CrO4+4CO2 物质的粒度为60目 H2SiO3 2![]() +2H+
+2H+![]() +H2O 0.25mol·L1 2.4×104 Na2Cr2O7+CH3OH+3H2SO4=2Cr(OH)SO4+CO2↑+Na2SO4+4H2O
+H2O 0.25mol·L1 2.4×104 Na2Cr2O7+CH3OH+3H2SO4=2Cr(OH)SO4+CO2↑+Na2SO4+4H2O ![]()
【解析】
由流程可知,铬渣加入纯碱、空气和辅料氧化煅烧,Cr2O3转化为Na2CrO4,存在的副反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3![]() 2NaAlO2+CO2↑,且水浸之后滤渣1中还原氧化铁和氢氧化钙,加入稀硫酸调节pH,除去溶液中的AlO2-、SiO32-,则滤渣2为氢氧化铝、硅酸;滤液中存在2
2NaAlO2+CO2↑,且水浸之后滤渣1中还原氧化铁和氢氧化钙,加入稀硫酸调节pH,除去溶液中的AlO2-、SiO32-,则滤渣2为氢氧化铝、硅酸;滤液中存在2![]() +2H+
+2H+![]() +H2O,经调节pH=a、蒸发结晶后可生成重铬酸钠,然后加入甲醇、硫酸将重铬酸钠还原为Cr(OH)SO4,据此分析解答。
+H2O,经调节pH=a、蒸发结晶后可生成重铬酸钠,然后加入甲醇、硫酸将重铬酸钠还原为Cr(OH)SO4,据此分析解答。
(1)“焙烧”时Cr2O3转化为Na2CrO4,反应化学方程式是2Cr2O3+4Na2CO3+3O2 ![]() 4Na2CrO4+4CO2,故答案为:2Cr2O3+4Na2CO3+3O2
4Na2CrO4+4CO2,故答案为:2Cr2O3+4Na2CO3+3O2 ![]() 4Na2CrO4+4CO2;
4Na2CrO4+4CO2;
(2)由图可知,“水浸”过程中,物料的粒度(颗粒大小)为60目时铬残余量最小,则最佳的反应条件为60目,故答案为:物质的粒度为60目;
(3)“滤渣2”的主要成分为Al(OH)3和H2SiO3,“过滤2”后,将溶液pH调至a,a小于6.5,目的是使![]() 转化为
转化为![]() +H2O,酸化时发生的反应为:2
+H2O,酸化时发生的反应为:2![]() +2H+
+2H+![]() +H2O,若1L酸化后所得溶液中含铬元素的质量为28.6g,
+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6g,![]() 有转化为
有转化为![]() ,说明铬元素有
,说明铬元素有![]() 转化为
转化为![]() ,根据铬元素守恒,存在关系式:2Cr~2
,根据铬元素守恒,存在关系式:2Cr~2![]() ~
~![]() ,n(
,n(![]() )剩余=
)剩余=![]() ×
×![]() =0.05mol,则n(
=0.05mol,则n(![]() )=0.25mol,因此酸化后所得溶液中c(
)=0.25mol,因此酸化后所得溶液中c(![]() )=
)=![]() =0.25molL-1,故答案为:H2SiO3;2
=0.25molL-1,故答案为:H2SiO3;2![]() +2H+
+2H+![]() +H2O;0.25molL-1;
+H2O;0.25molL-1;
(4)根据沉淀溶解平衡BaCrO4![]() +Ba2+,有Ksp(BaCrO4)=c(
+Ba2+,有Ksp(BaCrO4)=c(![]() )×c(Ba2+) =1.2×10-10=5.0×10-7×c(Ba2+),解得:c(Ba2+)=2.4×10-4mol/L,故答案为:2.4×10-4;
)×c(Ba2+) =1.2×10-10=5.0×10-7×c(Ba2+),解得:c(Ba2+)=2.4×10-4mol/L,故答案为:2.4×10-4;
(5)CH3OH被氧化生成CO2,根据流程图,Na2Cr2O7被还原为Cr(OH)SO4,反应的化学方程式为Na2Cr2O7+3H2SO4+CH3OH=2Cr(OH)SO4+Na2SO4+CO2↑+4H2O,故答案为:Na2Cr2O7+3H2SO4+CH3OH=2Cr(OH)SO4+Na2SO4+CO2↑+4H2O;
(6)用m1kg的铬渣(含Cr2O340%)制备Cr(OH)SO4,最终得到产品m2kg,由Cr原子守恒可知理论上生成产品的质量为![]() ×165g/mol×2kg=
×165g/mol×2kg=![]() kg,则产率为
kg,则产率为 ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】常温下,有![]() 的四种溶液:①
的四种溶液:①![]() ②
②![]() ③
③![]() ④
④![]()
(1)任选上述一种酸性溶液,用化学用语解释其呈酸性的原因:__________.
(2)溶液②的![]() _____________。
_____________。
(3)溶液②、③等体积混合后,溶液中![]() ________
________![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)溶液④加热后碱性增强,结合化学用语解释原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够说明硫的非金属性比氯弱的事实有
①![]() 与铁反应生成
与铁反应生成![]() ,S与铁反应生成FeS
,S与铁反应生成FeS
②![]() 和
和![]() 的混合气,经强光照射可剧烈反应,而S与
的混合气,经强光照射可剧烈反应,而S与![]() 反应需较高温度
反应需较高温度
③将![]() 通入氢硫酸中可置换出硫
通入氢硫酸中可置换出硫
④常温时硫单质为固态而氯单质为气态.
A.①③B.①②③C.②④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,向25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示。下列说法中正确的是
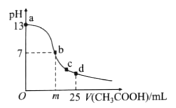
A.在b点的溶液中:m>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
B.在c点的溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.在d点的溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.在a一b的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子,![]() ,
,![]() ,
,![]() ,
,![]() 都具有相同的电子层结构,则下列叙述正确的是
都具有相同的电子层结构,则下列叙述正确的是
A. 原子半径A>B>D>C B. 原子序数D>C>B>A
C. 离子半径C>D>B>A D. 单质的还原性A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 把100 mL 3 mol·L-1的H2SO4跟100 mL H2O混合,硫酸的物质的量浓度为1.5 mol·L-1
B. 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
C. 把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol·L-1
D. 把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生。第二份加足量NaOH溶液加热后,收集到0.08mol气体。第三份加足量BaCl2溶液后,得到干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl-。__。
(2)由第二份进行的实验得知混合物中应含有__,其物质的量浓度为__。
(3)由第三份进行的实验可知12.54g沉淀的成分及物质的量是__。
(4)综合上述实验,你认为以下结论正确的是__。
A.该混合液中一定含有K+、NH4+![]() 、CO32-、SO42-,可能含Cl-,且n(K+)≥0.04mol
、CO32-、SO42-,可能含Cl-,且n(K+)≥0.04mol
B.该混合液中一定含有NH4+、CO32-、SO42-,可能含K+、Cl-
C.该混合液中一定含有NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl-
D.该混合液中一定含有NH4+、SO42-,可能含Mg2+、K+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据所给的10种元素,完成以下各小题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | H | |||||||
2 | C | N | F | Ne | ||||
3 | Na | Mg | Al | S | Cl |
(1)金属性最强的元素是______(填元素符号)。
(2)最不活泼元素的原子结构示意图为________。
(3)第3周期元素中,其最高价氧化物对应得水化物具有两性得元素是______(填元素名称)。
(4)Na、Mg两种元素中,原子半径较大的是______。
(5)第3周期中,某元素的一种氧化物是形成酸雨的主要物质,该氧化物的化学式为_______。
(6)工业上可以用Cl2和H2来制取盐酸该反应的方程式为_______________________________。
(7)HF与HCl热稳定性较强的是_________。
(8)由碳与氢元素形成的最简单有机物的化学式为_____,该物质中碳元素与氢元素的质量比为_________,其分子空间构型为_____________。
(9)重氢![]() 和超重氢
和超重氢![]() 两种核素都可用作制造氢弹的原料,它们所含中子数之比为____。
两种核素都可用作制造氢弹的原料,它们所含中子数之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是
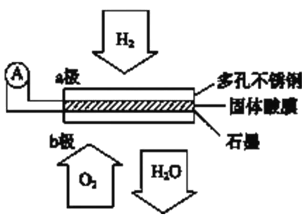
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e--=4OH--
C. 每转移0.1mol电子,消耗1.12L的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com