��������1���ǵ����������ڵ���ʶ��Ե�һ������������ָ����ˮ��Һ�л�����״̬���ܹ�����Ļ�������ǵ������ָ��������״̬��ˮ��Һ�ж����ܵ���Ļ����ǿ�������ָ��ˮ��Һ�У�������״̬������ȫ����Ļ����
��2���Ӵ�����������ʵĽǶȷ�����������Zn��Ӧͬʱ�������H
+��pH�仯�ϻ�����
��3��25��ʱ����pHΪa��HCl��Һ��pHΪb��NaOH��Һ��ȡVaL�������ø�NaOH��Һ�кͣ���V
bLNaOH��Һ������V
aL��10
-amol/L=V
bL��10
b-14mol/L����
=10
a+b-14���Դ������㣻
��4���ȸ����ᡢ���ȷ��PH��С��������������ͬ����Խ�������εļ���Խǿ���ݴ˷�������Һ��PHֵ��С��
��5�����������ˮ�⡢������ʵĵ�����������ݵ���غ������
����⣺��1��A��NH
3��ˮ��Һ�����һˮ�ϰ���һˮ�ϰ��ܵ���������ƶ������������Ӻ�笠������ӵ��µ��磬���ǰ����������룬�������Ƿǵ���ʣ�
B��SO
3ֻ���ڷ��ӣ�û�������ƶ������ӣ����Բ��ܵ��磻����������ˮ��Һ����ˮ��Ӧ�������ᣬ�������������ƶ��������Ӻ���������ӵ��磬���������������ܵ��룬���������Ƿǵ���ʣ�
C��Cl
2�ǵ��ʣ��Ȳ��ǵ���ʣ�Ҳ���Ƿǵ���ʣ�
D��BaSO
4�����Σ���ˮ��Һ�л�����״̬�£�����ȫ����ĵ���ʣ�����ǿ����ʣ���ǿ����ʣ�
E���ƾ����Ҵ����׳ƣ�������ΪҺ̬����ˮ��Һ�ﲻ�ܵ���������ƶ����������ӣ�ֻ���Ҵ����ӣ����ܵ��磬���Ծƾ��Ƿǵ���ʣ�
F��CH
3COONH
4��ˮ��Һ�������״̬������ȫ�������������Ӻ�笠����ӣ�������ǿ����ʣ�
G��HClO��ˮ��Һ��ֻ�в��ֵ��룬��ˮ�е��������������Ӻ������ӣ�������������ʣ�
�ʴ�Ϊ��ABE��DF��
��2�����ڴ�����������ʣ���Zn��Ӧͬʱ�������H
+������pH�仯�ϻ���������B�����Ǵ�����Һ��pH�仯���ߣ���ͼ֪����ʹ����pH�仯������2��4��������������Ũ����С���������д��ڵ���ƽ�⣬�����Ӻ�п��Ӧʱ�ٽ�������룬���䷴Ӧ�������ӣ����Դ����DZ߷�Ӧ�ߵ���H
+�������ĵ�Zn�࣬����m
1��m
2��
�ʴ�Ϊ��B������
��3��25��ʱ����pHΪa��HCl��Һ��pHΪb��NaOH��Һ��ȡVaL�������ø�NaOH��Һ�кͣ���V
bLNaOH��Һ������V
aL��10
-amol/L=V
bL��10
b-14mol/L����
=10
a+b-14����a+b��14����
=10
a+b-14��1����Va��Vb��
�ʴ�Ϊ��10
a+b-14������
��4����D��B��A��C���Σ�E�Ǽ���ʵ���Ũ����ͬ���⼸����Һ���ε�PHֵС�ڼ�ģ�����E��PHֵ���D��B��A��C�����ε���������ͬ������������Ӧ����Խ�����ε�pHֵԽ��������ԣ�̼������ԣ�ƫ��������ԣ�̼����������ʽ�Σ�̼���������Σ�����̼���Ƶ�pHֵ����̼�����Ƶģ�����ͬ���ʵ���Ũ�ȵ��⼸����Һ��pHֵ��С�����˳����DBACE��
�ʴ�Ϊ��DBACE��
��5��NH
4Cl+NaOH=NH
3��H
2O+NaCl
��Ӧǰ 0.01mol 0.002mol
��Ӧ 0.002mol 0.002mol 0.002mol 0.002mol
��Ӧ��0.008mol 0 0.002mol 0.002mol
������Һ�е�������NH
4Cl��NH
3��H
2O��NaCl��
NH
4Cl��ǿ���������ܷ���ˮ�⣬���Դ���ƽ�� ��ϵ�� NH
3��H
2O��H
2O����������ʣ����ֵ��룬���Դ���ƽ����ϵ��NH
3?H
2O?NH
4++OH
-��NH
4++H
2O?NH
3?H
2O+H
+��H
2O?H
++OH
-��Na
+��Cl
-��ˮ�⣬������Ũ�Ȳ��䣻��Һ�������������������ͬ����Һ�д��ڵ�����ΪNa
+��Cl
-��NH
4+��OH
-��H
+��
��n��Na
+��+n��NH
4+��+n��H
+��=n��Cl
-��+n��OH
-����n��Na
+��=0.002mol��n��Cl
-��=0.01mol��
����0.002mol+n��NH
4+��+n��H
+��=0.01mol+n��OH
-����n��NH
4+��+n��H
+��=0.008mol+n��OH
-����
����n��NH
4+��+n��H
+��-n��OH
-��=0.008mol��
�ʴ�Ϊ��NH
3?H
2O?NH
4++OH
-��NH
4++H
2O?NH
3?H
2O+H
+��Cl
-��Na
+��NH
4+��H
+��

 ��1��A��NH3 B��SO3 C��Cl2 D��BaSO4 E���ƾ� F��CH3COONH4
��1��A��NH3 B��SO3 C��Cl2 D��BaSO4 E���ƾ� F��CH3COONH4




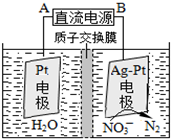 �����������Ǵ�����Ⱦ����Ҫ���أ�
�����������Ǵ�����Ⱦ����Ҫ���أ�