
【题目】近年来,随着聚酯工业的快速发展,将氯化氢转化为氯气的技术成为科学研究的热点。传统的Deacon直接氧化法,按下列催化过程进行:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)
(1)写出上述反应的平衡常数表达式K=___。
(2)生产过程中可使用CuCl2作催化剂,反应原理如下:
CuCl2(s)+![]() O2(g)=CuO(s)+Cl2(g) △H1=+63kJmol-1
O2(g)=CuO(s)+Cl2(g) △H1=+63kJmol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) △H2=-121kJmol-1
则4HCl(g)+O2(g)2Cl2(g)+2H2O(g)的△H=___kJmol-1。
(3)生产中反应温度通常控制在420℃左右,原因是___。在一定温度下,进一步提高HCl平衡转化率的方法是___(写出2种)。
(4)420℃时,将一定量的O2和HCl通入4L的恒容密闭容器中,反应过程中氧气的变化量如图所示,则0~20min平均反应速率v(HCl)为___molL-1·min-1。
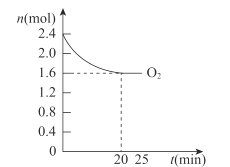
【答案】![]() -116 温度太低,反应速率太慢;温度太高,平衡逆向移动,产率降低 增加反应体系的压强、及时分离出产物 0.04
-116 温度太低,反应速率太慢;温度太高,平衡逆向移动,产率降低 增加反应体系的压强、及时分离出产物 0.04
【解析】
根据生成物浓度幂之积与反应物的浓度幂之积的比值表示化学平衡常数;利用盖斯定律计算焓变;从反应的能量变化和催化剂的角度分析,从化学平衡移动角度分析提高反应物转化率的方法;根据氧气的浓度变化量求出氧气的化学反应速率,根据化学反应速率之比等于化学计量数之比计算出氯化氢的化学反应速率。
(1)根据化学反应方程式4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)可知,化学平衡等于生成物浓度幂之积与反应物的浓度幂之积的比值,即反应的平衡常数表达式K=
2Cl2(g)+2H2O(g)可知,化学平衡等于生成物浓度幂之积与反应物的浓度幂之积的比值,即反应的平衡常数表达式K=![]() ;
;
(2)根据反应原理:①CuCl2(s)+![]() O2(g)=CuO(s)+Cl2(g)△H1=+63kJmol-1
O2(g)=CuO(s)+Cl2(g)△H1=+63kJmol-1
②CuO(s)+2HCl(g)=CuCl2(s)+H2O(g)△H2=-121kJmol-1
利用盖斯定律:2×(①+②)得到:4HCl(g)+O2(g)2Cl2(g)+2H2O(g)的△H=-116kJmol-1;
(3)生产中反应温度通常控制在420℃左右,是因为温度太低,反应速率太慢;温度太高,平衡逆向移动,产率降低;
若想提高HCl的转化率,应该促使平衡向着正向移动,该反应为反应前后气体体积减小的反应,根据勒夏特列原理,可以增加反应体系压强,使平衡正向移动;也可以及时除去产物,减小产物浓度,使平衡正向移动;
(4)由图可知,0~20min平均反应速率v(O2)=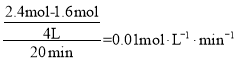 ,根据化学方程式:4HCl(g)+O2(g)2Cl2(g)+2H2O(g),v(HCl)=4v(O2)=0.04 molL-1·min-1。
,根据化学方程式:4HCl(g)+O2(g)2Cl2(g)+2H2O(g),v(HCl)=4v(O2)=0.04 molL-1·min-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,下列推断正确的是( )
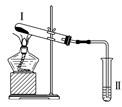
选项 | Ⅰ中试剂 | Ⅱ中试剂及现象 | 推断 |
A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解质溶液,电池总反应式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3。下列说法正确的是( )
A.电池工作时,锌是正极
B.电子由Zn电极通过外电路流向MnO2电极
C. MnO2电极发生氧化反应
D.外电路中每通过0.1 mol电子,锌的质量理论上减小6.5 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中NOx、SO2等污染物的有效去除和资源的充分利用是当今社会的重要研究课题,目前采用的方法如下:
I.直接转化法:利用高效催化剂将汽车尾气直接转化为无毒物质。
已知:N2(g)+O2(g)=2NO(g)△H1=+180kJ·mol-1
(1)利用固体表面催化工艺将NO分解为N2、O2而消除污染。
用![]() 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是________________________(填字母序号)。
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是________________________(填字母序号)。
![]()
(2)利用稀土等催化剂能将汽车尾气中的CO、NO直接转化成无毒物质N2、CO2。
①已知:C(s)、CO(g)的燃烧热分别为393kJ·mol-1、283kJ·mol-1,写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式________________________。
②为研究上述反应,某学习小组在密闭容器中充入10molCO和10molNO,发生上述①所写反应,实验测得平衡时NO的体积分数随温度、压强的关系如图。

a.某温度下的平衡状态D点,若同时采取缩小容器体积和降低温度,重新达到平衡状态时,可能到达图中A~G点中的________________________点。
b.当压强为10MPa、温度为T时的平衡常数Kp=________________________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留3位有效数字)。
II.催化还原法:利用还原剂在催化剂的作用下将氮氧化物转为无毒物质N2、CO2。
(3)用活性炭还原法可以处理汽车尾气中的氮氧化物。
某研究小组在2L的恒容密闭容器中加入一定量的NO和足量的固体活性炭,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如表:
N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如表:
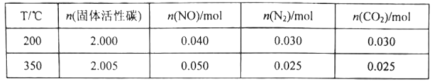
①该反应的正反应为________________________(填“吸热”或“放热”)反应。
②350℃时,反应达到平衡后向恒容容器中再充入0.100molNO,再次达到平衡后,N2的体积分数应为________________________。
A.0.5B.0.25C.介于0.25和0.5之间D.无法确定
III.电解法:利用电解的方法将氨氧化物转化为有用物质,从而达到资源的回收利用。
(4)如图所示的电解装置,可将雾霾中的NO2、SO2转化为硫酸铵,从而实现废气的回收再利用,回答下列问题:
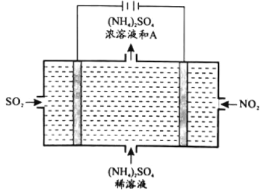
①阴极的电极反应式为________________________。
②上图中A物质是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图进行实验,探究H2O2的分解反应。
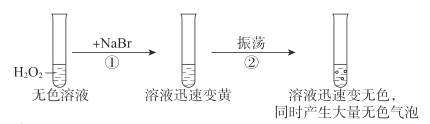
下列说法不正确的是( )
A.NaBr中的Br-加快了H2O2分解速率
B.双氧水既发生了氧化反应,又发生了还原反应
C.反应②的离子方程式是Br2+H2O2=2Br-+2H++O2↑
D.1molH2O2发生分解反应时,转移电子的物质的量是2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 在元素周期表中,p区元素的最外层电子排布均可表示为ns2np1~6
B. C2H4和HCN分子中,都含σ键和π键,但C原子的杂化方式并不相同
C. H2O、NH3、CH4分子中的O、N、C原子均采取sp3杂化
D. 用红外光谱可鉴别乙醇和二甲醚,用X-射线衍射实验可鉴别玻璃与水晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)在溶液中对生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=﹣lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是

A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯可用于制备二茂铁[Fe(C5H5)2];二茂铁分子是一种金属有机配合物,结构如图所示,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。下列说法正确的是( )
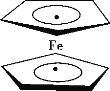
A.1mol环戊二烯(![]() )中含有5NA σ键
)中含有5NA σ键
B.二茂铁分子中存在配位键
C.环戊二烯分子中所有原子共平面
D.Fe2+的价电子排布式为3d44s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所得判断正确的是( )
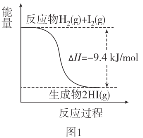
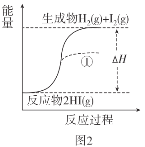
已知:I2(g)=I2(s) ΔH=-62.4kJ/mol
A.图1反应为吸热反应
B.图2反应的热化学方程式为2HI(g)![]() H2(g)+I2(g) ΔH=+9.4kJ/mol
H2(g)+I2(g) ΔH=+9.4kJ/mol
C.图2中若I2的状态为固态,则能量变化曲线可能为①
D.断裂1molH2(g)和1molI2(g)中化学键需要的能量大于断裂2molHI(g)中化学键需要的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com