
科目:高中化学 来源: 题型:阅读理解
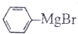 )与二苯酮反应制备三苯甲醇.
)与二苯酮反应制备三苯甲醇.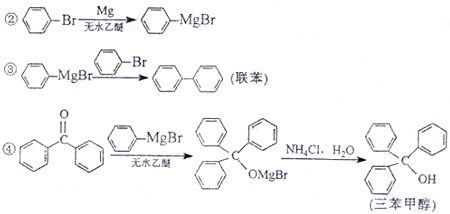
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
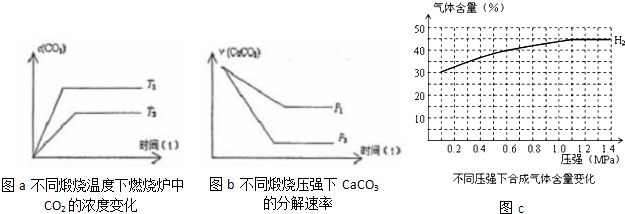
| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: ①C(s)+H2O(g)=CO(g)+H2(g) △H=+131.6kJ?mol-1 ②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ?mol-1 ③CaO(s)+CO2(g)=CaCO3(s) △H=-178.3kJ?mol-1 |
通入纯氧,主要化学反应: ④C(s)+O2(g)=CO2(g) △H=-393.8kJ?mol-1 ⑤CaCO3(s)=CaO(s)+CO2(g) K |
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气中含有NOx、CO及碳氢化合物,直接排入空气会造成大气污染,某研究性学习小组拟探究汽车尾气相关问题,请你参与并回答问题。
(1)有人建议汽车尾气中的CO,可用加入催化剂催化热分解的方法消除。已知热分解反应
CO(g)=c(s)+O2(g)的△H=+110.5kJ/mol,△S=-0.089kJ·mol-1.K-1,这一方案理论上是否可行,____________(选填:“可行”或“不可行”)。
![]() (2)有人提议在一定的条件下使NO、CO两种气体反应转变为N2和CO2,其方程式可表示为:2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-373.4kJ/mol.△S<0,又知该反应的平衡常数极大,常温下反应速率极小。
(2)有人提议在一定的条件下使NO、CO两种气体反应转变为N2和CO2,其方程式可表示为:2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-373.4kJ/mol.△S<0,又知该反应的平衡常数极大,常温下反应速率极小。
①上述反应的平衡常数表达式为:_________________________。
②下列有关说法正确的是_____________________________
A.减少CO和NO浓度的有效方法是加长汽车尾气排气管的长度
B.提高NO及CO转化率的有效方法是低温催化
C.汽车尾气中的NO主要是由于石油中含有大量的氮元素
D.使用催化剂,在适当温度和压力下有利干提高上述反应转化效率
(3)测定汽车尾气中NO,NO2的方法之一,用3%的H2o2溶液吸收生成HNO3,再用NaOH标准溶液滴定。若要确定尾气中NO,NO2体积分数总和,所需的数据有___________(选填序号)。
A.气体样品的体积 B.NaOH标准溶液的浓度及所消耗的体积
C.从滴定开始到指示剂变色所需的时间 D.两种氮氧化物的体积比
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)近年来,在超临界CO2(临界温度Tc = 304.3K;临界压力pc = 72.8×105Pa)中的反应引起广泛关注。该流体的密度在临界点附近很容易调制,可认为是一种替代有机溶剂的绿色溶剂,该溶剂早已用于萃取咖啡因。然而,利用超临界CO2的缺点之一是CO2必须压缩。
10-1 计算将CO2从1bar压缩到50bar所需的能量,其最终体积为50ml,温度为298K,设为理想气体。
10-2 实际气体用如下方程描述(近似的):
[p+a(n/V)2](V-nb) = nRT
对于CO2:a =3.59×105 Padm6mol-2 b = 0.0427dm3mol-1
分别计算在温度为305K和350K下为达到密度220gdm-3,330 gdm-3,440 gdm-3所需的压力。
10-3 超临界流体的性质,如二氧化碳的溶解能力和反应物的扩散性与液体的密度关系密切,上问的计算表明,在哪一区域――近临界点还是在较高压力或温度下更容易调制流体的密度?
10-4 在超临界二氧化碳中氧化醇类,如将苄醇氧化为苯甲醛,是一种超临界工艺,反应在催化选择性效率为95%的Pd/Al2O3催化剂作用下进行。
(1)写出主要反应过程的配平的反应式。
(2)除完全氧化外,进一步氧化时还发生哪些反应?
10-5 在另一超流体工艺合成有机碳酸酯和甲酰胺的例子中,二氧化碳既是溶剂又可作为反应物替代光气或一氧化碳。
(1)写出甲醇和二氧化碳反应得到碳酸二甲酯的配平的化学反应方程式,如以光气为反应物如何得到碳酸二甲酯?
(2)用适当的催化剂可用吗啉和二氧化碳合成甲酰基吗啉。该反应还需添加什么反应物?写出反应式;若用一氧化碳替代,反应式如何?
10-6 用绿色化学的观念给出用二氧化碳代替一氧化碳和光气的两个理由。与以CO或COCl2为反应物对比,再给出用CO2为反应物的1个主要障碍(除必须对二氧化碳进行压缩外)
注:吗啉的分子式为C4H9NO;结构式为:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com