
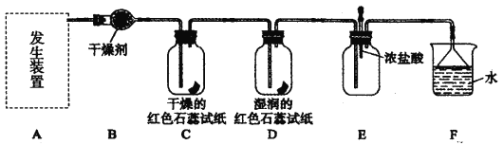
【题目】某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。 [制取氨气的反应原理: 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O]
CaCl2+2NH3↑+2H2O]
【实验探究】
(1) 利用上述原理,实验室制取氨气应选用下图中_______发生装置进行实验。

(2)B 装置中的干燥剂可选用________( 填“碱石灰”或“浓硫酸”)。
(3)用 5.35 g NH4Cl 固体与足量 Ca(OH)2 反应,最多可制得标准状况下氨气的体积为_________L。( NH4Cl 的摩尔质量为 53.5 g·mol-1)
(4)气体通过 C、D 装置时,试纸颜色会发生变化的是 __________( 填“C”或“D”)。
(5)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2 滴浓盐酸,可观察到的现象是__________。
(6)F装置中倒置漏斗的作用 _____________。
(7)某同学用氨气和滴加酚酞的水做喷泉实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有___________性质(填序号)。
a.还原性 b.极易溶于水 c.与水反应生成碱性物质
(8)氨气的用途很广。如可用氨气处理二氧化氮: 8NH3 + 6NO2 =7N2 + 12H2O该反应中氨气体现________( 填“氧化性”或“还原性”)。请你列举出氨气的另一种用途__________。
【答案】(1) a(1 分) (2)碱石灰(1分) (3) 2.24(2 分)
(4) D(1 分) (5)产生白烟(1 分) (6)防止倒吸(1分)
(7) bc(说明:若只选 b 或只选 c 给 1 分,其它只要出现 a 不给分)……(2 分)
(8)还原性(1 分)①致冷剂②氮肥(或化肥)的原料③硝酸的原料④化工原料
(以上任选其一,或其它合理答案也给分) (1 分)
【解析】
试题分析:(1)固体混合加热,可选择a发生装置进行实验;
(2)干燥管内盛放的是固体干燥剂,则干燥氨气可选用碱石灰;
(3)n(NH4Cl)=5.35g÷53.5g·mol-1=0.1mol,根据反应方程式可知,
n(NH3)=n(NH4Cl)=0.1mol,所以V(NH3)=nVm=0.1mol×22.4L/mol=2.24L;
(4)氨气能使湿润的红色石蕊试纸变蓝,所以D中颜色发生变化;
(5)氨气与挥发的HCl会生成氯化铵晶体,所以有白烟生产;
(6)氨气极易溶解于水,利用F装置中倒置漏斗可防倒吸;
(7)利用氨气和滴加酚酞的水做喷泉实验,烧瓶内产生红色喷泉的现象,说明氨气极易溶于水且氨气与水反应生成碱性物质,答案为bc;
(8)在8NH3 + 6NO2 =7N2 + 12H2O反应中氨气中氮元素化合价升高,被氧化,体现还原性,氨气常见用途有①致冷剂②氮肥(或化肥)的原料③硝酸的原料④化工原料等。


科目:高中化学 来源: 题型:
【题目】为验证烷烃分子中含有碳、氢两种元素,可将其燃烧产物通过:①浓硫酸;②澄清石灰水;③无水硫酸铜。正确的顺序是
A.①②③ B.②③ C.②③① D.③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D之间的转化关系如图所示。下列说法正确的是
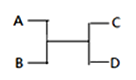
A.若A为Fe,D为氢气,则B一定为酸
B.若A、D为化合物,B为水,则C一定是气体单质
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图,下列判断中正确的是

A.向烧杯a中加入少量KOH溶液,有白色沉淀生成
B.烧杯b中发生反应为2Zn-4eˉ=2Zn2+
C.电子从Zn极流出,流入Fe极,经盐桥回到Zn极
D.烧杯a中发生反应O2 + 4H++ 4eˉ= 2H2O,溶液pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 1 mol的乙烷在光照条件下最多能与3 mol Cl2发生取代反应
B. 石油裂解气能使溴的四氯化碳溶液、酸性KMnO4溶液褪色
C. 水煤气可用来合成液态烃及甲醇等含氧有机物
D. 苯可通过取代反应制得硝基苯、氯苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应为 N2(g)+3H2(g) ![]() 2NH3(g)△H=+92.4kJmol﹣1,下列说法正确的是( )
2NH3(g)△H=+92.4kJmol﹣1,下列说法正确的是( )
A.一定条件下,当N2的生成速率与N2的分解速率相等时,该反应处于平衡状态
B.取1mol N2和3mol H2放在密闭容器内反应达平衡时,生成2 mol NH3
C.一定条件下反应达到平衡,再充入N2,则正反应速率增大,逆反应速率减小
D.一定条件下反应达到平衡,若升高温度,反应速率增大,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
A. 分液、蒸馏、萃取 B. 萃取、蒸发、分液
C. 分液、萃取、蒸馏 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为化学常见的纯净物,A是单质.它们之间有如下的反应关系:

(1)若B是气态氢化物,C、D是氧化物且C是造成酸雨的主要物质。B与C可反应生成A,写出该反应的化学方程式:
(2)若A是太阳能电池用的光伏材料,B为A单质的氧化物,C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出B→C的离子方程式:
(3)若B为淡黄色固体,②③反应均用到同一种液态氢化物,D物质常用于食品工业。
B所含化学键的类型是 。写出B→C的化学方程式: .
(4)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体.写出C→D的离子方程式: .
(5)若A是应用最广泛的金属,④反应用到A,②⑤反应均用到同一种非金属单质。写出C→D的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定是重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于下图所示的装置中进行中和热的测定实验,回答下列问题:
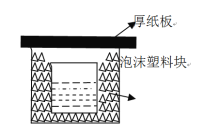
(1)从图中实验装置看,其中尚缺少的两种玻璃用品是_,为保证该实验成功,该同学采取了许多措施,如图的泡沫塑料块的作用在于。
(2)倒入NaOH溶液的正确操作是:(从下列选出)。
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
D.简述测量温度的方法
(3)实验记录数据如表
项目 | 反应起始温度T1(℃) | 终止温度T2(℃) | T2-T1 | ||
HCl | NaOH | 平均温度 | |||
第1次 | 26.2 | 26.0 | 29.4 | ||
第2次 | 27.0 | 27.4 | 32.2 | ||
第3次 | 25.9 | 25.9 | 29.1 | ||
第4次 | 26.4 | 26.2 | 29.7 | ||
设0.55mol/LNaOH溶液和0.50mol/L盐酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=(取到小数点后一位)。
(4)不能用醋酸代替盐酸做此实验,原因是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com