
����Ŀ���к��ȵIJⶨ����Ҫ�Ķ���ʵ�顣ȡ0��55mol/L��NaOH��Һ50mL��0��50mol/L������50mL������ͼ��ʾ��װ���н����к��ȵIJⶨʵ�飬�ش��������⣺
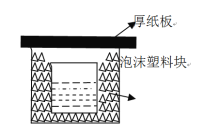
��1����ͼ��ʵ��װ�ÿ���������ȱ�ٵ����ֲ�����Ʒ��_��Ϊ��֤��ʵ��ɹ�,��ͬѧ��ȡ�������ʩ����ͼ����ĭ���Ͽ������������
��2������NaOH��Һ����ȷ�����ǣ���������ѡ������
A���ز�������������
B����������������
C��һ��Ѹ�ٵ���
D�����������¶ȵķ���
��3��ʵ���¼�������
��Ŀ | ��Ӧ��ʼ�¶�T1������ | ��ֹ�¶�T2������ | T2-T1 | ||
HCl | NaOH | ƽ���¶� | |||
��1�� | 26��2 | 26��0 | 29��4 | ||
��2�� | 27��0 | 27��4 | 32��2 | ||
��3�� | 25��9 | 25��9 | 29��1 | ||
��4�� | 26��4 | 26��2 | 29��7 | ||
��0��55mol/LNaOH��Һ��0��50mol/L������Һ���ܶȶ���1g/cm3���кͺ�������Һ�ı�����c��4��18J/��g�����������к�����H����ȡ��С�����һλ����
��4�������ô��������������ʵ�飬ԭ����____________________��
���𰸡���ÿС��2�֣����8������1�����ν��������¶ȼ�
�����кͷ�Ӧ����������ɢʧ�����������2��C����ʱ�۲��¶ȼ�ʾ�������������¶ȴﵽ���ʱ��ƽ�ӿ̶ȶ�����3��-55��2kJ/mol��55��2��1�֣�-kJ/mol��1����ȫ�Ը�2������4�����������ᣬ�����ڵ�������У�Ҫ�����кͷ�Ӧ�ų�������
��������
�����������1���ڷ�Ӧ��������Ҫ���裬���Ի�ȱ�ٻ��β��۽������ͬʱ����Ҫ������Һ�¶ȣ���˻�ȱ���¶ȼƣ������ڷ�Ӧ������Ҫ�����ܼ�����������ʧ��������ĭ���Ͽ���������ڼ����кͷ�Ӧ����������ɢʧ�����������
��2����������������Һ�Ĺ���Խ����������ʧ��Խ�࣬����Ϊ����������ʧ��Ӧ����һ��Ѹ�ٵ��룬��ѡC�������¶ȵķ���������ʱ�۲��¶ȼ�ʾ�������������¶ȴﵽ���ʱ��ƽ�ӿ̶ȶ�����
ʵ���е���ֽ���������ȣ�������������ʧ�����á�
��3�����ݱ����ݿ�֪���Ĵ��¶Ȳ�ֱ���������3��3��5��0��3��2��3��4�����Եڶ��ε�ʵ�����̫����ȥ������¶Ȳ��ƽ��ֵ����3��3��3��2��3��4����3��3��3������Ӧ������ˮ�����ʵ�����0��025mol������Ӧ�зų�����������50��50��g��4��18J/��g��������3��3����1379��4J������к�����H����0��13794kJ��0��025mol����55��2kJ/mol��
��4�����������ᣬ�����ڵ��������Ҫ�����кͷ�Ӧ�ų������������������ô��������������ʵ�顣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
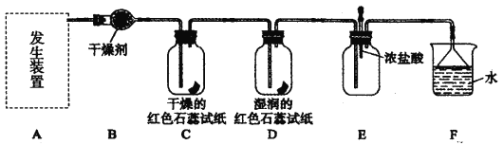
����Ŀ��ij��ѧ��ȤС��Ϊ����ȡ��̽���������ʣ�������װ��(���ּг�װ������ȥ)����ʵ�顣 [��ȡ�����ķ�Ӧԭ���� 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O]
CaCl2+2NH3��+2H2O]
��ʵ��̽����
(1) ��������ԭ����ʵ������ȡ����Ӧѡ����ͼ��_______����װ�ý���ʵ�顣

(2)B װ���еĸ������ѡ��________( ���ʯ�ҡ���Ũ���ᡱ)��
(3)�� 5.35 g NH4Cl ���������� Ca(OH)2 ��Ӧ�������Ƶñ�״���°��������Ϊ_________L��( NH4Cl ��Ħ������Ϊ 53.5 g��mol��1)
(4)����ͨ�� C��D װ��ʱ����ֽ��ɫ�ᷢ���仯���� __________( �C����D��)��
(5)��ʵ�����һ��ʱ���ѹEװ���еĽ�ͷ�ιܣ�����1��2 ��Ũ���ᣬ�ɹ۲쵽��������__________��
(6)Fװ���е���©�������� _____________��
(7)ijͬѧ�ð����͵μӷ�̪��ˮ����Ȫʵ�飬������ƿ�ڲ�����ɫ��Ȫ������˵����������___________����(�����)��
a����ԭ�� b����������ˮ c����ˮ��Ӧ���ɼ�������
(8)��������;�ܹ㡣����ð����������������� 8NH3 + 6NO2 =7N2 + 12H2O�÷�Ӧ�а�������________( ������ԡ���ԭ�ԡ�)�������оٳ���������һ����;__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
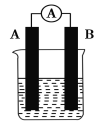
����Ŀ��ij�о���ѧϰС����̽��ԭ��ص��γ�����������ͼ��ʾװ�ý���ʵ�鲢�õ��±�ʵ������
ʵ����� | A | B | �ձ��е�Һ�� | ����������ָ���Ƿ�ƫת |
1 | Zn | Zn | �Ҵ� | �� |
2 | Zn | Cu | ϡ���� | �� |
3 | Zn | Cu | ϡ���� | �� |
4 | Zn | Cu | �� | �� |
5 | Cu | C | �Ȼ�����Һ | �� |
6 | Mg | Al | ����������Һ | �� |
��������ʵ�飬�ش��������⣺
(1)ʵ��2�е�����________������________��(�A����B��)��
(2)ʵ��6�е�����B������A��������������________(�þ��������)�缫��
(3)ʵ��5����________(����ĸ��ţ���ͬ)��
A��ͭ�ڳ�ʪ�����в��ᱻ��ʴ
B��ͭ�ĸ�ʴ���Է����е�
(4)�����ϱ��й���Ϣ������˵������ȷ����________��
A�������˳����У�������ǿ�Ľ���һ��������
B��ʧȥ���ӵĵ缫�Ǹ���
C���ձ��е�Һ������ǵ������Һ
D��ԭ����У�����ͬһ�������Һ�е������缫���ǻ����Բ�ͬ�����ֽ���(������һ�ַǽ���)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪c(NH4Cl)��0.1mol/Lʱ����ҺpH>5.1������0.1 mol/L����ζ�10mL0.05 mol/L��ˮ���ü�����ָʾ�����ﵽ�ζ��յ㣬������������Ϊ
A. 10mL B. 5mL C. ����5 mL D. ��5 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2+Cl2![]() 2HCl��һ�������£�ijH2��Cl2�Ļ������7.5 g ����3.612��1023��ԭ�ӣ���ַ�Ӧ������˵����ȷ������ ��
2HCl��һ�������£�ijH2��Cl2�Ļ������7.5 g ����3.612��1023��ԭ�ӣ���ַ�Ӧ������˵����ȷ������ ��
A����Ӧ�������������ͬ״���¿������ܶȴ�
B����Ӧ�����������ڱ�״���µ����Ϊ6.72L
C����Ӧ������������Hԭ�Ӻ�Clԭ�ӵ����ʵ���֮��Ϊ1��2
D����Ӧ����������ɱ�100mL 1mol/L NaOH��Һ��ȫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������������ԭ������������ ��
A����״����5.6L ���� B��4��ʱ9mLˮ
C��11gCO2 D��6.02��1022��H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬѧ����Fe2+��ԭ�Ե�ʵ�飬����쳣�������̽����
ʵ�飺��2 mL FeCl2��Һ�еμ�2��0.1 molL-1 KSCN��Һ���������ٵμ�5��5% H2O2��Һ�����ʵ���Ũ��ԼΪ1.5 molL-1��pHԼΪ5�����Ի����������۲쵽��Һ��죬��Լ10�����Һ�ɫ��ȥ�����������ɣ�������ΪO2����
��1�������ӷ���ʽ��ʾʵ������Һ����ԭ�� �� ��
��2����̽��ʵ������Һ��ɫ��ԭ��
I��ȡ��ɫ����Һ���ݣ�һ�ݵμ�FeCl3��Һ��������һ�ݵμ�KSCN��Һ���ֺ�ɫ��
II��ȡ��ɫ����Һ���μ������BaCl2��Һ��������ɫ������
III����2 mL 0.1 molL-1 FeCl3��Һ�еμ�2��0.1 molL-1 KSCN��Һ����죬ͨ��O2�������Ա仯��
�� ʵ��I˵�� ����ʵ��III˵�� ��
�ó����ۣ���Һ��ɫ��ԭ��������������H2O2��SCN-������SO42-��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ������������Ӧˮ����Ļ�ѧʽ��HXO3 �� ������̬�⻯��Ļ�ѧʽΪ�� ��
A.HX
B.H2X
C.XH3
D.XH4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com