
| A. | 钢铁插入水中,水下部分比空气与水交界处更容易腐蚀 | |
| B. | 钢铁在海水中比在河水中更易腐蚀,主要是由于海水中有大量电解质 | |
| C. | 钢铁设备上连接铜块可以防止钢铁腐蚀 | |
| D. | 钢铁设备与外加直流电源的正极相连可以防止钢铁腐蚀 |
分析 A.空气和水是钢铁发生腐蚀的条件;
B.钢铁混有少量的碳杂质,在潮湿的空气中容易形成原电池,海水中含有氯化钠电解质;
C.铁、铜相连和合适的电解质溶液能构成原电池,铁作负极;
D.电解池中阳极和电源正极连接,活性电极失电子发生氧化反应溶解;
解答 解:A.空气和水是钢铁发生腐蚀的条件,其它条件相同时,氧气浓度越大,钢铁腐蚀越严重,空气和水交界处氧气浓度大于水下,所以钢柱在水下部分比在空气与水交界处更不容易腐蚀,故A错误;
B.原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.河水中电解质含量少,海水中含有大量的氯化钠,所以钢铁在海水中比在河水中更易腐蚀,故B正确;
C.铁、铜相连和合适的电解质溶液能构成原电池,铁作负极,负极上铁易失电子而被腐蚀,故C错误;
D.钢铁设备与外加直流电源的负极相连可以防止钢铁腐蚀,钢铁设备与外加直流电源的正极相连反而会加快钢铁设备的腐蚀,故D错误;
故选B.
点评 本题考查了铝、氮气、硅、二氧化硅性质应用,主要是化学腐蚀、阴极电保护的原理,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molAl3+离子含有的电子数为3NA | |
| B. | 1molCl2含有1 NA个原子 | |
| C. | 23g钠在22.4L(标况下)Cl2中反应,转移电子数NA个 | |
| D. | 欲配制1.00L 1.00mol.L-1的NaCl溶液,可将 58.5gNaCl溶于 1.00L水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含Cl2的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含Cl2的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:CH4>NH3>H2O>HF | B. | 熔沸点:CaO>BaO>NaCl>KCl | ||
| C. | 熔沸点:Na>Mg>Al | D. | 熔沸点:HF<HCl<HBr<HI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 常温下,0.1mol/L NH4NO3溶液中NO3-的数目为0.1NA | |
| C. | 标准状况下,11.2L CCl4中含有分子的数目为0.5NA | |
| D. | 室温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
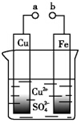
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Cu2++2e Cu Cu | |
| C. | a和b用导线连接时,Fe为负极,Cu为正极,化学能转化为电能 | |
| D. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol H2O中含有的原子总数为1.5 NA | |
| B. | 0.2mol O2 所占有的体积为4.48L | |
| C. | 22g 二氧化碳气体中所含有的分子数目为0.5 NA | |
| D. | 100mL2mol/L的Na2CO3溶液中含有的Na+数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2O2/% | 5 | 10 | 15 | 20 | 25 | 30 |
| CaO2/% | 62.40 | 63.10 | 63.20 | 64.54 | 62.42 | 60.40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com