
| A. | 日本的水俣病是由重金属镉污染引起的 | |
| B. | 垃圾处理要遵循无害化、减量化和资源化的原则 | |
| C. | 水体的富营养化是由于水体中植物营养物质过多蓄积而引起的污染 | |
| D. | 污水处理中混凝法、中和法、沉淀法、氧化还原法等都是化学方法 |
分析 A.重金属镉能使蛋白质发生变性;
B.垃圾为放错位置的资源,应加以利用;
C.水中氮、磷元素的增多会引起水体的富营养化污染;
D.混凝法可为物理方法.
解答 解:A.日本的水俣病是由重金属镉污染引起的,重金属镉能使蛋白质发生变性,故A正确;
B.垃圾为放错位置的资源,应加以利用,则垃圾处理要遵循无害化、减量化和资源化的原则,故B正确;
C.氮、磷元素是植物的营养元素,水中氮、磷元素的增多会引起水体的富营养化污染,故C正确;
D.加活性炭或高分子聚合氯化铝等作混凝剂时为物理方法,加无机盐作混凝剂为化学方法,中和法、沉淀法、氧化还原法均发生化学反应,中和法、沉淀法、氧化还原法均为化学方法,故D错误;
故选D.
点评 本题考查三废处理及环境保护,为高频考点,把握常见的环境污染问题、污水处理方法为解答的关键,侧重分析与应用能力的考查,注意化学与环境的联系,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
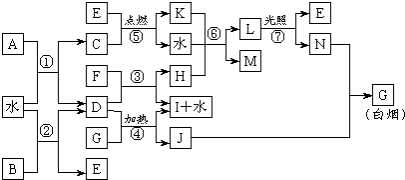
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离碘单质和四氯化碳的混合物需要烧杯、玻璃棒和漏斗 | |
| B. | 用湿润的pH试纸测定溶液的pH一定会产生误差 | |
| C. | 实验室可以向浓硫酸中滴加浓盐酸制取少量氯化氢 | |
| D. | 用浓氨水可以除去试管内壁银镜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质参加和单质生成的化学反应一定是氧化还原反应 | |
| B. | 盐酸是强酸,所以盐酸是强电解质 | |
| C. | 向FeCl3饱和溶液滴加NaOH溶液可制备Fe(OH)3胶体 | |
| D. | 化合反应不一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
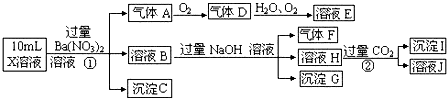
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com